- 122.50 KB
- 2022-04-29 14:44:41 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
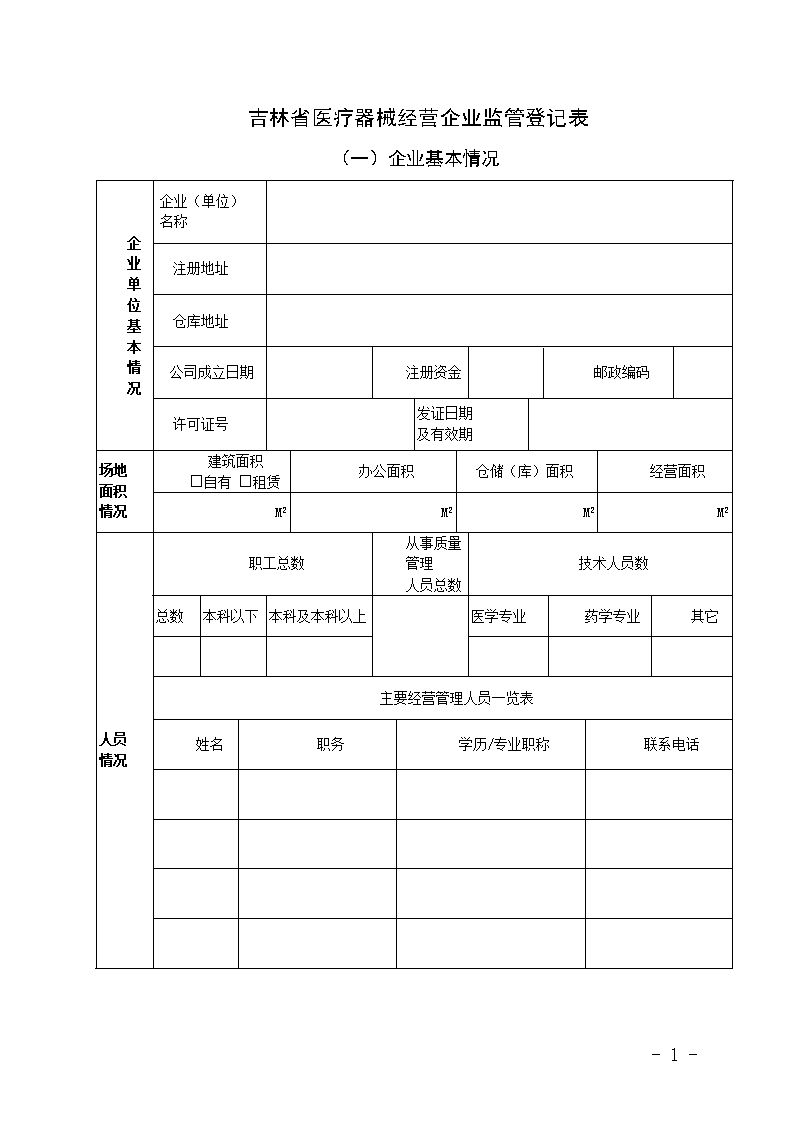
'吉林省医疗器械经营企业监管登记表(一)企业基本情况企业单位基本情况企业(单位)名称 注册地址 仓库地址 公司成立日期 注册资金 邮政编码 许可证号发证日期及有效期场地面积情况建筑面积□自有□租赁办公面积仓储(库)面积经营面积M2M2M2M2人员情况职工总数从事质量管理人员总数技术人员数总数本科以下本科及本科以上医学专业药学专业其它主要经营管理人员一览表姓名职务学历/专业职称联系电话-15-
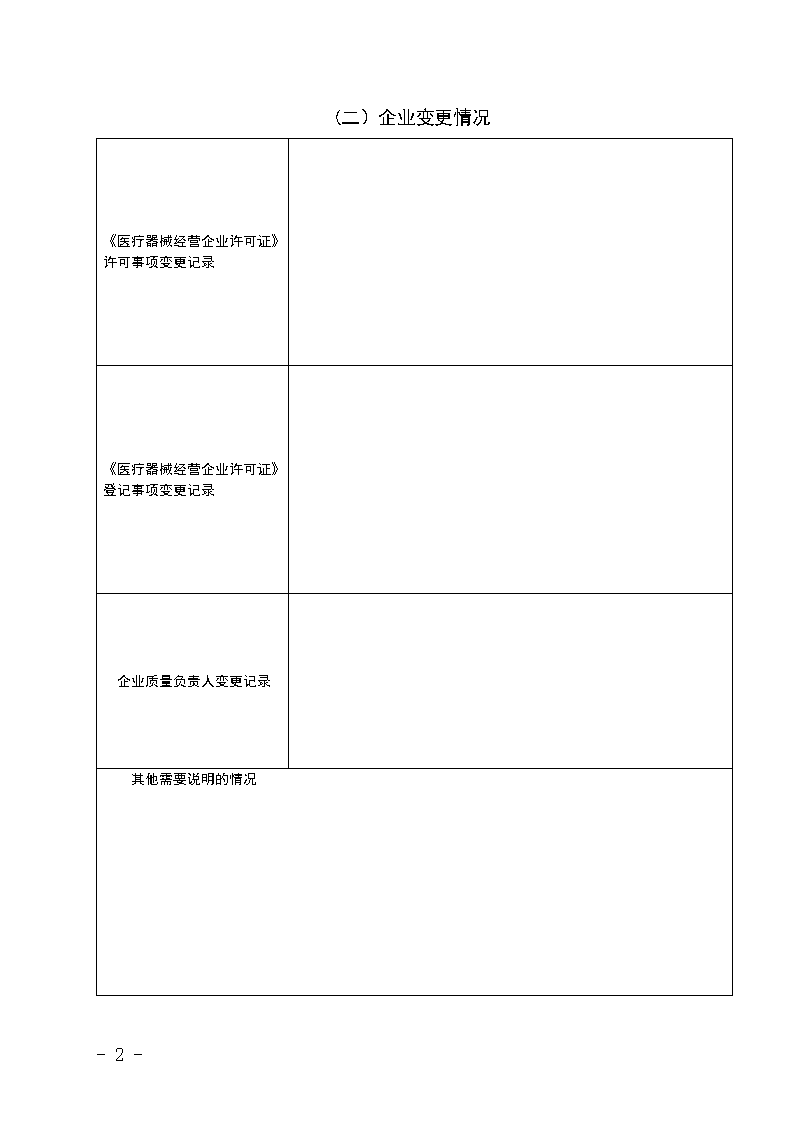
(二)企业变更情况《医疗器械经营企业许可证》许可事项变更记录《医疗器械经营企业许可证》登记事项变更记录企业质量负责人变更记录其他需要说明的情况-15-
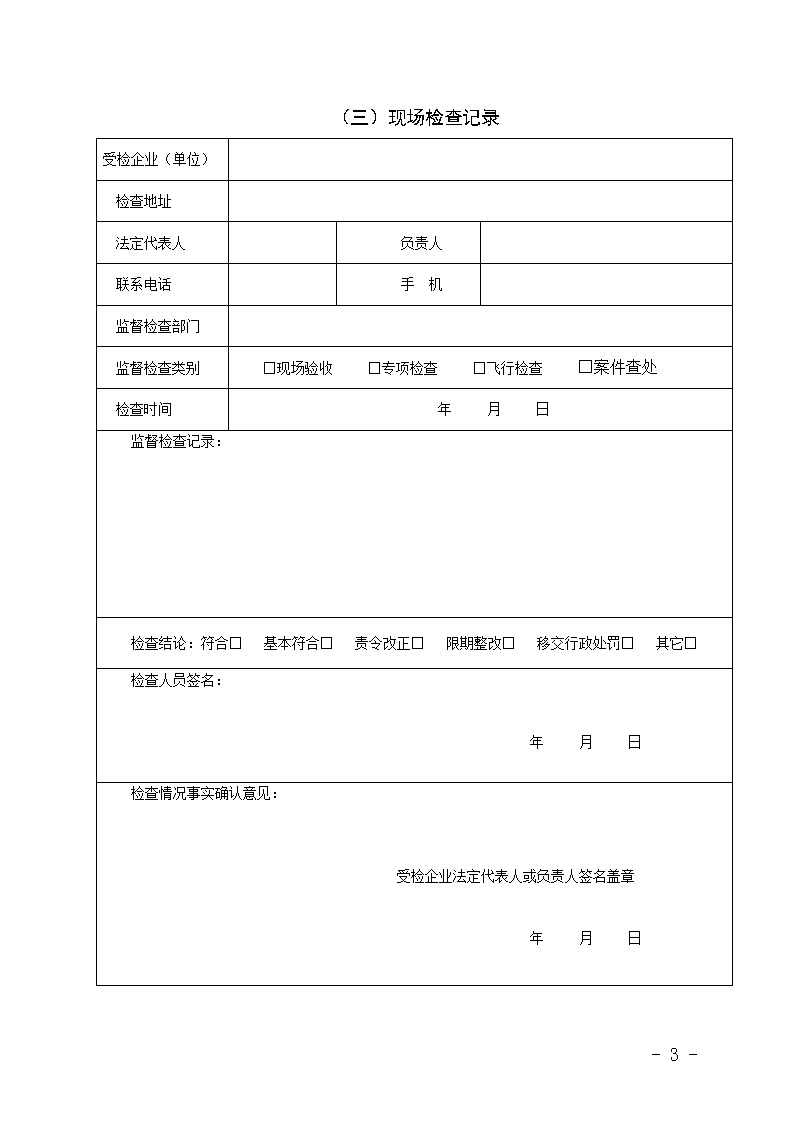
(三)现场检查记录受检企业(单位)检查地址法定代表人负责人联系电话手机监督检查部门监督检查类别□现场验收□专项检查□飞行检查□案件查处检查时间年月日监督检查记录:检查结论:符合□基本符合□责令改正□限期整改□移交行政处罚□其它□检查人员签名:年月日检查情况事实确认意见:受检企业法定代表人或负责人签名盖章年月日-15-
(四)质量事故、不良事件情况产品质量事故情况(简要描述)(附记录、报告等)产品质量事故调查处理情况(附记录、报告等)发生不良事件情况(简要描述)(附记录、报告等)不良事件调查处理情况(附报告、记录等)(五)投诉、举报核查情况质量投诉及处理情况(附记录等)举报核查及处理情况(附记录等)(六)信用管理情况(七)食品药品监督管理部门依法实施检查的其他记录-15-
现场检查记录附页-15-
体验式温热治疗仪监督检查整改情况整改意见整改后复查情况整改验收责任人:上报整改报告时限在监督检查发现案件查处情况立案情况:案件办结时间:案件查处责任人:案件移交情况移交部门:移交时间:移交人:归档责任人年月日经办人签字年月日-15-
体验式温热治疗仪监督检查案件查处受检企业受检地址法定代表人负责人联系电话监督检查部门监督检查类别□现场验收□质量体系考核□质量管理规范□专项检查□飞行检查□案件查处检查时间年月日立案时间年月日结案时间年月日案件查处情况立案情况:案件办结时间:案件查处责任人:案件查处情况移交部门:移交时间:移交人:监督检查结论及处理意见:归档责任人年月日经办人签字年月日-15-
体验式温热治疗仪经营企业现场检查表企业名称注册地址经营范围经营企业许可证号联系电话现场检查情况现场检查结果行政措施检查人员及时间组长: 检查组成员:年月日企业负责人员意见(盖章)年月日-15-
吉林省温热治疗仪生产企业监管登记表(一)企业基本情况(由企业填写)企业名称电话及传真注册地址邮政编码生产地址电子信箱生产企业许可证编号发证日期及有效期医疗器械注册证编号另附发证日期及有效期另附企业法定代表人联系电话企业负责人联系电话职工总数专业技术人员比例生产范围注册资金年产值年销售额总建筑面积生产面积仓储面积(总)原材料库面积成品库面积半成品、中间体库面积包装、物料库面积办公场所面积质检室面积其他面积产品标准另附执行标准情况管理者代表是否是内审员内审员人数专职质检员人数企业质量负责人学历/所学专业/职称是否在岗或兼职企业生产负责人学历/所学专业/职称是否在岗或兼职企业技术负责人学历/所学专业/职称是否在岗或兼职主要生产设备另附生产设备运行及满足生产情况主要检测设备、检测仪器另附检测设备、仪器是否满足出厂检测要求计量器具是否按规定检测、是否在有效期内使用-15-
产品包装、标签、说明书是否符合“10号令”要求产品包装、标签、说明书更改备案情况 (二)企业变更情况(由企业填写) 《医疗器械生产企业许可证》许可事项变更记录《医疗器械生产企业许可证》登记事项变更记录《医疗器械注册证》许可事项变更记录《医疗器械注册证》登记事项变更记录-15-
其他需说明的情况(三)企业质量体系考核情况(由监管人员填写)是否按0287-2008标准建立质量体系是否通过质量体系认证(认证机构名称)企业质量体系认证跟踪检查情况企业质量体系考核情况(考核时间、首次注册或重新注册时是否通过考核)企业质量体系考核跟踪检查情况(附记录)实施体系情况体系检查情况(附记录)(四)产品出厂检验及监督检查情况(由监管人员填写)产品出厂检验情况产品委托检验情况产品监督检(抽)验情况(附报告)及跟踪检查情况(附记录)-15-
(五)重大质量事故、不良事件情况(由监管人员填写)重大产品质量事故情况(简要描述)(附记录、报告等)重大产品质量事故调查处理情况(附记录、报告等)发生不良事件情况(简要描述)(附记录、报告等)不良事件调查处理情况(附报告、记录等)(六)投诉、举报核查情况(由监管人员填写)质量投诉及处理情况(附记录等)举报核查及处理情况(附记录等)(七)现场监督检查情况(由监管人员填写)现场监督检查时间检查目的□日常监督检查□专项检查□规范监督检查□投诉举报□其他检查的依据质量体系考核□现有实施细则□其它:参加检查人员及所在单位现场检查情况存在主要问题(附检查员现场检查记录)涉及条款其中不合格项严重缺陷项,一般缺陷项;检查结论:检查员签字:年月日整改要求处理意见及处理结果-15-
(八)信用管理情况(由监管人员填写)守信□警示□失信□严重失信□(九)企业奖惩情况(由监管人员填写)表彰记录处罚记录不良行为记录(十)食品药品监督管理部门依法实施检查的其他记录(由监管人员填写)-15-
温热治疗仪生产企业现场检查表-15-
企业名称注册地址检查产品名称生产企业许可证号联系电话现场检查情况现场检查结果行政措施检查人员及时间组长: 检查组成员:年月日企业负责人员意见(盖章)年月日-15-'