- 2.21 MB
- 2022-04-29 14:46:42 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第二节 离子反应(共2课时)
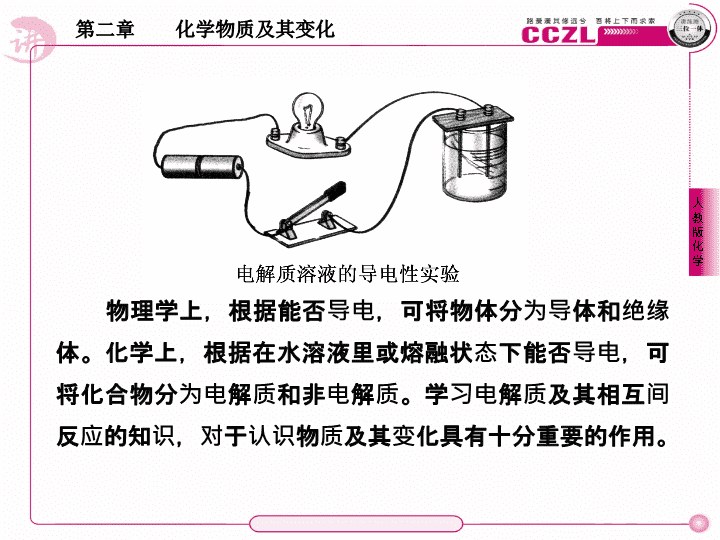
物理学上,根据能否导电,可将物体分为导体和绝缘体。化学上,根据在水溶液里或熔融状态下能否导电,可将化合物分为电解质和非电解质。学习电解质及其相互间反应的知识,对于认识物质及其变化具有十分重要的作用。
你有没有被蜜蜂或黄蜂刺过?被刺伤是很痛的,而且伤口会肿胀。被蜜蜂刺到的伤口可以敷上小苏打(碳酸氢钠)溶液或膏,因为蜜蜂的刺是酸性的,小苏打是碱性的,所以可以发生中和作用,减轻伤口的肿胀,消除痛楚。被黄蜂刺到的伤口则以醋或柠檬汁来中和,因为它是酸性的。思考:1.物质溶于水后为什么有的显酸性?有的显碱性?2.酸、碱、盐在溶于水的过程中会发生怎样的变化?
NaCl溶液实验表明:NaCl溶液能导电。这是为什么呢?我们可以从物质的结构和它们在水中溶解时所发生的变化进行分析。NaClNa+Cl-由阳离子和阴离子构成的离子化合物灯泡发光
图2-9NaCl在水中的溶解过程
●梳理导引1.电解质:____________叫电解质。电离是电解质溶于水或受热熔化时,离解成____________的过程。在电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数______________,溶液显______________性,称为电荷守恒。2.酸、碱、盐的电离:电离时生成的阳离子全部是____________的化合物叫做酸。电离时生成的阴离子全部是________________的化合物叫做碱。电离时能生成____________和____________的化合物叫做盐。
4.电解质溶液的导电性因为电解质溶液中含有____________的离子,所以电解质溶液能导电。
3.电离方程式:HNO3===________________________________________________________________________,H2SO4===________________________________________________________________________,NaOH===________________________________________________________________________,Ba(OH)2===________________________________________________________________________,
Na2SO4===________________________________________________________________________,NH4Cl===________________________________________________________________________。
4.电解质溶液的导电性因为电解质溶液中含有____________的离子,所以电解质溶液能导电。
●问题探究1.在导电性实验中,为什么氯化钠晶体不导电,而熔融的氯化钠和氯化钠水溶液以及大家熟悉的金属都可以导电?电解质导电的前提条件和实质是什么?
阶段总结化学物质分类化学物质纯净物混和物单质电解质化合物非电解质
提示:带电粒子的定向移动就可以形成电流,像电子、阴离子、阳离子等。金属内的电子本来就是自由电子,当外加电场时可以定向移动形成电子流而导电。氯化钠晶体内虽然有阴阳离子,但不能自由移动,即使有外加电场,也不能定向移动形成电流。而氯化钠在熔融态或在水溶液中,吸收了来自热或水分子作用等外界的能量,而离解出自由移动的钠离子和氯离子,即发生了电离,当外加电场作用时,离子从自由移动状态改为分别向两极定向移动而形成带电离子流,使电流通过电解质溶液而导电。因为电离的结果是产生了自由移动的离子,所以电离是电解质导电的前提条件(而电离的条件是加热熔融或溶于水);电解质导电的本质,就是在电离状态下阴阳离子的定向移动,即阳离子移向阴极,阴离子移向阳极。
2.电解质和非电解质以及酸、碱、盐这些概念有什么区别和联系?为什么说酸、碱、盐是电解质?电解质和非电解质的本质区别是什么?非电解质的水溶液一定不导电吗?
提示:把同一种化合物按不同的分类方法可划分出不同的类别,当按化合物的组成与结构来分时,可分为离子化合物和共价化合物;当按性质来分时,可分为酸、碱、盐、氧化物等;当按在水溶液或熔化状态下是否显示导电这个性质来分时,(本质上是看能否电离)可分为电解质和非电解质。一种化合物不是电解质就是非电解质,任何酸、碱、盐都是电解质。从电离角度看酸、碱、盐的定义可知,它们都可以在电离的条件下电离,所以说它们都是电解质。电解质与非电解质的本质区别是在水溶液或融化状态下本身能否电离,而其水溶液是否导电只是这个本质决定的一种性质而已。非电解质的水溶液不一定不导电,可能是它与水反应生成了电解质,例如SO2、SO3、NH3等非电解质的水溶液可以导电。
3.划分强电解质和弱电解质的唯一标准是什么?是看其水溶液的导电能力吗?提示:划分的唯一标准就是只看电解质在电离时是否完全电离,即由本质决定,不是看导电能力。电解质的强弱跟导电能力的强弱没有必然联系,导电能力的强弱主要取决于自由移动的离子的浓度大小和离子所带电荷的多少。很稀的强电解质溶液或难溶性的强电解质溶液的导电能力就很弱,而有些弱电解质的浓溶液中电离产生的离子浓度大,导电能力可以很强。
●细品教材1.电解质和非电解质概念的理解对电解质与非电解质概念的准确理解要把握以下三点:(1)从物质分类看,电解质属于纯净物中的化合物。“化合物”指电解质在元素组成上的所属类别。非电解质研究的对象也是化合物。
温馨提示:酸、碱、盐等化合物都是电解质,在这里要把电解质和电解质溶液区分开来。如盐酸能导电,但它是氯化氢的水溶液,是混合物,所以盐酸既不是电解质,也不是非电解质,而是电解质溶液。(2)从物质性质看,电解质在一定条件下能导电。“能够导电”是在上述条件下,电解质具有的性质。电解质能够导电的原因,在于电解质在水溶液或熔融状态下离解成自由移动的离子。
温馨提示:“溶于水或熔融”是电解质电离的条件。在这里要把化合物溶于水形成溶液,同化合物跟水发生化学反应生成新物质区分开来。
2.电解质与非电解质的判断电解质与非电解质的本质区别是看化合物自身在熔融状态下或在水溶液中能否发生电离,而溶液的导电只是一个表面现象。确定某物质是否为电解质应从以下几个方面进行分析:(1)看该物质是否为化合物。如金属单质中有自由电子能导电,但金属单质既不是电解质,也不是非电解质;氯气的水溶液能导电,但氯气不是电解质,也不是非电解质。因为电解质、非电解质均针对于化合物而言,而非单质、混合物。
(2)看该物质溶于水或熔融状态下是否发生电离。有的化合物难溶于水,如BaSO4、AgCl等,它们在水分子的作用下难以电离,但在熔融时能发生电离产生自由移动的离子而能导电,它们属于电解质。有的化合物熔融状态下不能发生电离产生自由移动的离子,例如液态的氯化氢、乙酸等,但它们在水分子的作用下能产生自由移动的离子,它们的水溶液能够导电,那么它们仍属于电解质。所以要注意“或”这一关键字,“或”是选择关系。
(3)看溶于水是否发生了化学反应,是哪种物质发生了电离。例如:SO3、SO2、CO2等的水溶液中存在有自由移动的离子,它们的水溶液的确能导电,但这些自由移动的离子并不是上述化合物本身直接产生的,而是这些物质与水发生了化学反应生成新的物质H2SO4、H2SO3、H2CO3等,然后由这些新的物质再在水分子作用下产生了自由移动的离子,因此我们不能说SO3、SO2、CO2是电解质,而只能说H2SO4、H2SO3、H2CO3是电解质。SO3、SO2、CO2是非电解质。综上所述,电解质导电只是一个表面现象,要抓住导电的本质。
●典例精析【例1】(山东临朐一中2009-2010学年度高一上学期期中考试,10)下列物质属于电解质的一组是()A.CO2、SO2、HClB.H2SO4、K2O、BaSO4C.H3PO4、H2O、CuD.NH3、CH4、NaCl【解析】电解质为在水溶液中或熔化状态下能自身发生电离,因产生自由移动的离子而导电的化合物。而CO2、SO2、NH3溶于水导电不是它们自身的电离,故它们不是电解质。Cu虽能导电,但它是单质。【答案】B
【例2】下列叙述正确的是()A.氯化钠溶液能导电,所以氯化钠溶液是电解质B.固态氯化钠不导电,但氯化钠是电解质C.氯化氢溶液能导电,所以氯化氢是电解质D.铜能导电,所以铜是电解质【解析】选项A不正确,因为氯化钠溶液是混合物,所以氯化钠溶液不是电解质。氯化钠这种化合物在水溶液中能导电,所以氯化钠是电解质。
选项B正确。氯化钠不导电,是因为缺少水溶液或熔融的外界条件,NaCl晶体里的Na+和Cl-不能自由移动,所以不能导电。如果有了外界条件——水溶液或熔融,氯化钠就能导电,所以氯化钠是电解质。选项C正确。氯化氢是共用电子对偏移程度较大的共价化合物,液态时虽不导电,但在水分子作用下能完全电离成自由移动的H+和Cl-,氯化氢在水溶液中能导电,所以氯化氢是电解质。选项D不正确。铜是金属导体,铜能导电是由于铜中自由电子的定向移动。但铜是单质,不是化合物,所以铜不是电解质。【答案】BC
【点评】电解质并不一定导电,导电的物质不一定是电解质,产生自由移动的离子是电解质导电的前提,而电解质能产生自由移动的离子,是电解质的内因,还必须具备一定的外因条件,这就是电解质溶于水或受热使电解质呈熔融状态。
(山东五莲2009-2010学年度上学期期中考试)下列说法正确的是()A.液态HCl、固体NaCl均不导电,所以HCl、NaCl均是非电解质B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质C.铜、石墨均导电,所以它们是电解质D.蔗糖、酒精在水溶液或熔融时均不导电,所以它们是非电解质
【解析】HCl、NaCl溶于水均能导电,都是电解质,A错误。NH3、CO2溶于水导电是因为生成了NH3·H2O、H2CO3为电解质,B错误。铜和石墨都是单质,不是电解质,C错误。【答案】D
掌握电解质和非电解质的概念,能熟练判断一种物质是否是电解质是认识电解质的性质、研究离子反应的前提。以下有10种物质:①铜②稀硫酸③氯化氢④氨气⑤空气⑥二氧化碳⑦金属汞(俗称水银)⑧氯化钠⑨硫酸钡⑩氯气按照表中提示的信息,把符合左栏条件的物质的化学式或名称填入右栏相应的位置。
序号符合的条件物质的化学式或名称(1)混合物(2)电解质,但熔融状态下并不导电(3)电解质,但难溶于水(4)非电解质(5)既不是电解质,也不是非电解质,但本身能导电
【解析】解答此类题目应先明确电解质、非电解质的概念及其判断的依据,然后根据题给物质的组成、性质等进行分析归纳。10种物质中稀硫酸和空气属于混合物。HCl溶于水可电离出H+、Cl-,能导电,但熔融状态下不存在自由移动的离子,不导电,故HCl属于电解质。BaSO4是难溶性电解质。而NH3、CO2的水溶液虽然能导电,但不是它们本身发生了电离,而是它们与水发生了反应,生成了电解质NH3·H2O和H2CO3,故它们属于非电解质。铜和金属汞属于单质,不是化合物,故既不是电解质也不是非电解质,但能导电。
【答案】序号符合的条件物质的化学式或名称(1)混合物②稀硫酸⑤空气(2)电解质,但熔融状态下并不导电③氯化氢(3)电解质,但难溶于水⑨BaSO4(4)非电解质④NH3⑥CO2(5)既不是电解质,也不是非电解质,但本身能导电①铜⑦金属汞
●细品教材1.电离的概念:电解质在溶于水或熔融状态下离解成自由移动的离子的过程称为电离。2.电离的适用范围:电解质。电解质包括酸、碱、盐。
3.电离条件:溶于水或受热熔化。但对于每一种具体物质,电离条件又有所不同。离子化合物型物质电离的条件:如NaCl加入水中水分子与NaCl晶体作用NaCl溶解并电离出Na+、Cl-;受热熔化时,在热能的作用下,晶体里的阴、阳离子在一定的范围之内振动而自由移动,即电离产生Na+、Cl-。共价化合物型物质的电离条件:绝大多数的共价化合物,在固态和液态下均不电离,其溶于水后在水分子的作用下发生电离。4.电离结果:产生自由移动的阴阳离子。
●典例精析【例3】下列叙述中正确的是()A.氯化镁的晶体不能导电的原因是氯化镁晶体中不含阴、阳离子B.在电流作用下氯化钠在水溶液中电离成钠离子和氯离子C.氯化钾晶体不能导电而其水溶液能导电的原因是氯化钾与水发生化学反应产生了钾离子和氯离子D.氯化钾晶体不能导电的原因是构成氯化钾晶体的钾离子和氯离子不能自由移动,而溶于水后在水分子的作用下产生了自由移动的钾离子和氯离子,所以其水溶液能导电
【解析】电解质的电离是指电解质溶于水或者熔融状态下产生能自由移动的离子的过程,电离并不需要外加电流就能发生,故B项错误;氯化镁晶体是由镁离子和氯离子构成的,其晶体之所以不导电是因为镁离子、氯离子束缚在晶体上不能自由移动,故A项错误;氯化钾溶于水并没有发生化学反应,水溶液中的钾离子、氯离子,氯化钾本身就含有。【答案】D
【点拨】电解质的电离与是否有外加电流没有关系,电解质电离的外因条件是把电解质加入水中或者将电解质熔融。对于离子化合物的电解质而言,其离解产生的自由离子是该离子化合物本身就含有的,只不过在其晶体中这些离子不能自由移动而已。
【点拨】对于强电解质MxRy,若其物质的量浓度为cmol·L-1,则c(My+)=x×cmol·L-1,c(Rx-)=y×cmol·L-1。
(福建龙岩一中2009-2010学年度高一上学期模块考试)下列电离方程式中,正确的是()
【答案】C
【答案】AC
【点拨】KHSO4能电离出H+和K+,但因阳离子不全是H+,故不属于酸,而符合盐的定义,属酸式盐。同理Cu2(OH)2CO3虽能电离出OH-,但也不属于碱,属碱式盐。
●资料备选1.如何判断某物质是否为电解质应从以下几个方面理解:(1)电解质、非电解质的基本前提是化合物。(2)化合物具备以下两个条件中的至少一个即为电解质:①在水溶液里能导电;②在熔融状态下能导电。应注意以上两个条件不一定全具备。例如,HCl是电解质,但它只在水溶液中能导电,而在熔融状态时则不导电,再加NH4HCO3根本就不存在熔融状态;Na2O是电解质,但它只在熔融状态导电,其水溶液虽能导电,但并不是它自身电离的结果,只能通过熔融状态这一个方面判断。
2.电离方程式的书写(1)强电解质的电离方程式由于强电解质在电离条件下(溶于水或受热熔化)完全电离为自由移动的阴、阳离子,因此,写强电解质的电离方程式时用“===”号。如:
(3)多元弱酸的电离方程式多元弱酸的电离是分步进行(发生)的,其电离方程式要分步写,如:H2CO3(二元弱酸)的电离为
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之,则不能言,不过旬日必死”。不久,蜀军先锋王平率数百军士前来探路,由于天气炎热,人马均争先恐后误喝哑泉水。果然回营后大难临头——军士们个个说不出话来,生命危在旦夕,诸葛亮也毫无办法。此时,幸巧遇见一老叟,经指点,蜀军众将士及时饮用万安溪安乐泉水,终于逐渐转危为安,渡过难关。经当代化学工作者实地分析研究,发现哑泉泉水中含有较多的硫酸铜,人喝了含有铜盐的水就会中毒,引起说话不清,呕吐
腹泻,最后虚脱、痉挛而死。那么喝了万安溪安乐泉水又为何转危为安呢?原来该泉水中含有较多的碱(一般味苦),在人体误食CuSO4后又大量饮此泉水,其中碱先中和了胃酸,然后多余的碱又会在胃肠中与CuSO4发生离子反应Cu2++2OH-===Cu(OH)2。致使原来会使人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而不再会被吸收,因此,具有解毒作用。
●梳理导引1.离子反应电解质在溶液中的反应实质是____________之间的反应。2.离子反应发生的条件:离子反应的特点就是向着降低某些离子浓度或数目的方向进行:(1)____________,(2)____________,(3)____________。3.离子方程式:____________________________。
4.离子方程式的意义:________________________________________________________________________。5.书写离子方程式的步骤:(1)写:____________________________;(2)拆:将化学方程式中____________的物质拆写成阴、阳离子符号;而______________、________________和____________用化学式表示。(3)删:删去方程式等号两边____________的离子。(4)查:检查是否满足__________、__________等。
6.离子共存:在溶液中能够相互结合生成________的物质、____________的物质、____________的物质的离子不共存。
参考答案:1.离子2.(1)生成难溶的物质(2)生成易挥发的物质(3)生成难电离的物质3.用实际参加反应的离子符号表示离子反应的式子4.表示化学反应的实质,表示同一类型的离子反应5.(1)写出正确的化学方程式(2)易溶于水、易电离 难溶物质 难电离物质 气体(3)没有反应(4)质量守恒 电荷守恒6.难溶 易挥发 难电离
●问题探究1.如何理解离子反应?提示:电解质是离子反应的基础,有离子参加或生成的反应叫做离子反应。离子反应发生的条件是生成难溶(沉淀)、难电离(如水)或挥发性(气体)物质。即有难溶性物质(如BaSO4、AgCl等)生成或有难电离物质(如H2O等)生成或有挥发性物质即气体(如CO2、NH3等)生成。离子反应可用离子方程式表示,离子方程式是用实际参加反应离子的符号表示离子反应的式子。
离子方程式揭示了化学反应的本质。不同的化学反应,只要反应实质相同,就可用同一离子方程式表示,表示的是一类化学反应。(1)离子方程式和化学方程式的区别化学方程式只能描述一个化学反应,离子方程式可以描述一类化学反应。化学方程式不能揭示化学反应的本质,离子方程式揭示了化学反应的本质。
离子反应可以检验某种离子(或某些离子)是否存在。如向某溶液中加AgNO3溶液和稀硝酸,有白色沉淀生成且不溶解,证明该溶液中含有Cl-:Ag++Cl-===AgCl
(2)离子反应发生条件实质离子反应总是伴随着离子的种类及浓度或数目变化,离子反应的本质是离子间发生反应生成了新离子或旧离子消失;有难溶性物质(如BaSO4、AgCl等)生成或有难电离物质(如H2O)生成或有挥发性物质即气体(如CO2、NH3等)生成。只要具备上述条件之一,这类离子反应就能发生。常见的沉淀可见溶解性表;例如钾盐、钠盐、硝酸盐和铵盐易溶于水;氯化物难溶氯化银;硫酸盐难溶硫酸钡和硫酸铅等。常见的气体有CO2、SO2、NH3等。
2.离子反应在混合物分离、物质提纯和鉴定,以及消除水中污染物等方面有重要意义,请举出几个具体实例,并与同学交流。
2.酸、碱、盐之间离子反应发生的条件以离子反应的观点来看,酸、碱、盐等电解质在溶液里发生的复分解反应,实质上就是两种电解质在溶液中相互交换离子的反应(离子反应)。这类离子反应发生的条件就是复分解反应发生的条件,即有难溶的物质(如BaSO4、CaCO3、AgCl)生成或难电离的物质(如CH3COOH、H2O)生成或挥发性物质(如CO2、NH3、SO2)生成,只要具备上述条件之一,这类离子反应就能发生。
温馨提示:(1)并不是参加离子反应的所有反应物都是电解质。即离子反应的定义应是:有离子参加或有离子生成的反应就是离子反应。(2)中学阶段所学离子反应一般限于在水溶液中进行的反应,即水溶液中有电解质参加的反应。另外离子化合物在熔融状态下的反应也是离子反应。(3)某些强电解质,包括离子化合物固态下的热反应,只要没有熔化,就不是离子反应。
3.离子方程式的书写步骤——写、拆、删、查(1)写——写出反应的化学方程式。(2)拆——把化学方程式中易溶于水,易电离的物质拆写成离子形式。(3)删——将不参加反应的离了从方程式等号两端删去。(4)查——检查方程式两端各元素的原子个数和电荷数是否相等。
温馨提示:试一试,看下列口诀对你有帮助吗?书写离子方程式,记住步骤共有四。物质易溶易电离,离子形式来表示。气体、难溶、难电离,表示则以化学式。微溶反应写离子,生成却写化学式。写完左右查守恒,原子、电荷要看清。例如:碳酸钙与盐酸的反应:
4.离子方程式的意义离子方程式不仅可以表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。5.书写离子方程式要注意的问题(1)强酸、强碱和易溶于水的盐改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。(2)微溶物作为反应物,若是澄清溶液写离子形式,若是悬浊液写化学式。微溶物作为生成物,一般写成化学式(标号)。
(3)氨水作为反应物时写成NH3·H2O;作为生成物,若有加热条件或浓度很大时,可写NH3(标号)。(4)固体与固体间的反应不能写离子方程式。(5)多元弱酸酸式酸根离子,在离子方程式中不能拆开写。
温馨提示:离子方程式的正误判断的方法离子方程式的正误判断应从以下几个方面分析:(1)看离子反应是否符合客观事实。不可主观臆造产物及反应,如2Fe+6H+===2Fe3++3H2就不符合客观事实。
(6)看是否符合题设条件及要求。如“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序等对反应方程式的影响。如向澄清石灰水中通入少量CO2的离子方程式为
●典例精析【例1】下列离子反应不能发生的是()A.HCl+NaOH===NaCl+H2OB.AgNO3+NaCl===AgCl+NaNO3C.KHCO3+HCl===KCl+CO2+H2OD.2HCl+Na2SO4===2NaCl+H2SO4【解析】离子反应发生的条件为生成难溶物质或微溶物,生成气体或挥发性物质,生成难电离的物质。A项生成H2O为难电离的物质;B项生成AgCl是难溶物质;C项生成气体;D项不符合离子反应的条件。【答案】D
【例2】(山东五莲2009-2010学年度上期期中考试)下列反应的离子方程式书写正确的是()A.Ba(OH)2溶液中加入稀硫酸:
【答案】B
Cl-+Ag+===AgCl↓【解析】分析错因,改正错误的反应。A中电荷不守恒,改为:Cu+2Ag+===Cu2++2Ag。B中CaCO3不溶于水,因写成化学式,改为:CaCO3+2H+===Ca2++H2O+CO2↑。C中电荷不守恒,改为2Na+2H2O===2Na++2OH-+H2↑。【答案】D【点拨】判断离子反应正误时应特别注意电荷是否守恒。
(2010年全国Ⅱ理综,6)下列反应中可用离子方程H++OH-=H2O表示的是()A.NH4Cl+NaOHNaCl+NH3↑+H2OB.Mg(OH)2+2HClMgCl2+2H2OC.NaOH+NaHCO3===Na2CO3+H2OD.NaOH+HNO3===NaNO3+H2O【解析】H+代表强酸、OH-代表强碱,所以A项中H+不能代表NH4Cl,B项中是Mg(OH)2弱碱,C项中NaHCO3是弱酸的酸式盐而不是强酸,故只有D项符合题意。【答案】D
●细品教材几种离子在同一溶液中,若离子之间不能发生反应,就能大量共存,否则不能大量共存。离子不能大量(“大量”指浓度大)共存的原因从本质上说就是具备了离子反应发生的条件。
1.能发生离子反应的不能共存(1)形成难电离物质而不共存(如形成H2O、NH3·H2O等)。(2)形成挥发性物质而不共存(如能形成H2S等)。
【解析】A选项中四种离子不能相互反应可共存,但Fe3+在溶液中是有色的,不符合无色的隐含条件。D选项的四种离子也是可以共存的,但会与题干中隐含条件“强酸性”暗示的H+反应,不符合要求。B选项中Ag+与Cl-反应生成AgCl,不能大量共存。【答案】C
【答案】B
(1)甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子是____________、__________、__________。(2)乙厂的废水中含有另外三种离子。如果加一定量____________(选填“活性炭”、“硫酸亚铁”或“铁粉”),可以回收其中的金属____________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的____________(填写离子符号)转化为沉淀。经过滤后的废水主要含____________,可用来浇灌农田。
【答案】(1)K+、Cl-、OH-(2)铁粉Ag(3)Ag+、Fe3+、Cl-、OH-KNO3
●细品教材1.混合物的分离如对于含有Mg2+、Na+、Ba2+、Cl-的溶液,取少量向其中加入稍过量的NaOH溶液后过滤,再向滤液中加入稍过量的H2SO4溶液后再过滤,这样就将共存的Mg2+、Ba2+和Na+分离了。
2.物质的提纯如对于含有Na2SO4的粗盐,加水溶解后先加入过量的BaCl2溶液,再加入稍过量的Na2CO3溶液,过滤;向滤液中加入稍过量的HCl溶液,蒸发结晶,即得精盐。3.离子检验和未知物的鉴定一般地说检验和鉴定物质常常需要从离子入手,它是基本知识和实验技能的综合运用,应掌握常见离子及其化合物的特征,以便进行准确检验和推断。
【答案】B
【例6】(河南大学附属中学2009-2010学年度高一上学期期中考试,11)某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种离子。(1)不做任何实验就可以肯定原溶液中不存在的离子是________。(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是________,有关的离子方程式为________________________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有__________________________。(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)________。
【答案】(1)Cu2+(2)Ag+;Ag++Cl-===AgCl↓(3)Mg2+(4)B
(山东师范大学附中2009-2010学年度高一上学期期中考试,20)工业废水含有Cu2+、Ba2+、Ag+要求加入三种试剂,每次只沉淀一种离子,写出加入第一种试剂时,所发生反应的离子方程______________________________。
【答案】Cl-+Ag+===AgCl↓
【答案】Ba(OH)2Al2(SO4)3K2CO3Fe(NO3)3
●资料备选1.书写离子方程式应注意的问题(1)难溶物质(难溶盐、氢氧化物、H2SiO3等)、单质、氧化物(Na2O、SiO2等)、气体物质均写化学式。(2)没有自由移动离子参加的反应,不能写离子方程式。如NH3(气)+HCl(气)===NH4Cl。(3)多数弱酸酸式盐的酸根在离子方程式中保留化学式。如NaHCO3与NaOH反应,应写成
(4)微溶物[如Ca(OH)2]的处理看反应条件①当Ca(OH)2作为生成物时应用化学式;②当Ca(OH)2作为反应物时,若是澄清石灰水,Ca(OH)2应写离子形式;若是石灰乳参加反应,Ca(OH)2要写成化学式。(5)注意某些反应中量的关系如Ca(HCO3)2与NaOH溶液反应,
2.溶解性口诀难溶、易溶、微溶的物质虽然在“溶解性表”中有明确指出,但难以记忆,下列溶解性口诀可以实现快速记忆,由于口诀有很多种,现为大家提供一个韵律较好、易于理解的无机盐类溶解性口诀,以供参考:钾、钠、硝酸、铵盐(溶)盐酸盐除银、亚汞(不溶)硫酸盐除钡和铅(不溶)磷、碳、硅酸、亚硫酸只溶钾、钠、铵
说明:①钾盐、钠盐、硝酸盐、铵盐均溶于水;②盐酸对应的盐除了氯化银、氯化亚汞不溶于水外,其他一般均溶于水;③硫酸盐除了硫酸钡、硫酸铅不溶于水外,其余基本都溶于水;④磷酸盐、碳酸盐、硅酸盐、亚硫酸盐只有对应的钾盐、钠盐、铵盐溶于水,其他盐则不易溶于水或难溶于水;⑤一些酸式盐如碳酸氢盐、磷酸二氢盐、亚硫酸氢盐一般溶于水。
'
您可能关注的文档
- 《独坐敬亭山》课件PPT 人教版四年级语文下册.ppt
- 《8的乘法口诀》课件PPT.ppt
- pep小学四年级英语上册Unit5WhatWouldYouLike第一课时优质课课件PPT.ppt
- 《苏州园林》优秀课件PPT分析.ppt
- 《詹天佑》课件.ppt课件PPT汇编.ppt
- 初中美术课件PPT(1).ppt
- 幼儿园中班数学课件PPT_有趣的图形 (2).ppt
- 轴对称图形课件PPT下载北师大版三年级数学下册课件.ppt
- 液压与气压传动 课件PPT 第一章 液压与气动概述.ppt
- 高一化学必修一第三章第二节几种重要的金属化合物课件PPT精品资料1.ppt
- 高分子化学第五版第1章课件PPT.ppt
- 健康教育课件PPT模板下载.pptx
- 二年级美术上册课件PPT 青花盘.ppt
- 二年级语文下册雷雨课件PPT(精美,公开课)精讲.ppt
- (苏教版)一年级数学上册课件PPT5以内的加法.ppt
- 人教版五年级数学下册:正方体的认识课件PPT.ppt
- 幼儿园中班数学课件PPT_有趣的图形-副本.ppt
- 苏教版五年级下册数学分数与小数的互化课件PPT.ppt