- 964.50 KB
- 2022-04-29 14:31:20 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第八章开环聚合Ring-OpeningPolymerization1国家级精品课程──高分子化学
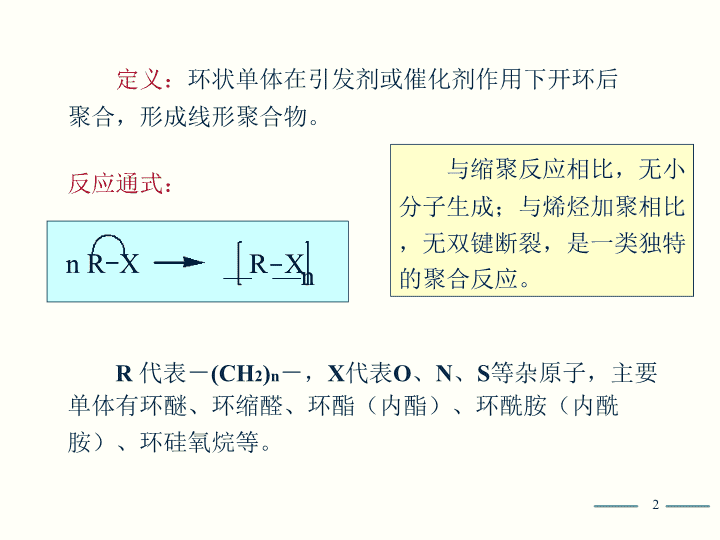
——n定义:环状单体在引发剂或催化剂作用下开环后聚合,形成线形聚合物。反应通式:R代表-(CH2)n-,X代表O、N、S等杂原子,主要单体有环醚、环缩醛、环酯(内酯)、环酰胺(内酰胺)、环硅氧烷等。2nR-XR-X与缩聚反应相比,无小分子生成;与烯烃加聚相比,无双键断裂,是一类独特的聚合反应。
3开环聚合的推动力:环张力的释放开环聚合的机理:大部分属离子聚合(连锁),小部分属逐步聚合。开环聚合的单体:环醚、环缩醛、环酯、环酰胺、环硅烷等。环氧乙烷、环氧丙烷、己内酰胺、三聚甲醛等的开环聚合都是重要的工业化开环聚合反应。
8.1环烷烃开环聚合热力学能否开环及聚合能力的大小环的大小(元数)、构成环的元素(碳环或杂环)、环上的取代基等都对开环的难易都有影响。取决于环和线性结构的相对稳定性,属热力学因素。有的环状化合物难以开环,如γ—丁氧内酯、六元环醚等;有的聚合过程中环状单体和聚合物之间存在平衡,如己内酰胺。双官能度单体线性缩聚还有环化倾向。4
51)环大小的影响键角大小:与环大小有关键的变形程度:环烷烃键角与正常键角(109o28’)差值之半环的张力能:每一亚甲基的张力与环中亚甲基数的积聚合热:开环时,环张力能以聚合热形式释放聚合自由焓等。键的变形程度愈大,环的张力能和聚合热愈大;聚合自由焓越负,环的稳定性愈低,愈易开环聚合。环张力的表示方法:
6三、四元环环张力很大(三元环60°,四元环90°),环不稳定而易开环聚合;五元环键角接近正常键角,张力较小,环较稳定。五元以上环可不处于同一平面使键角变形趋于零而难开环。六元环常呈椅式结构,键角变形为0,不能开环聚合。八元以上有跨环张力,环上氢或取代基造成斥力,聚合能力较强。十一元以上跨环张力消失,环较稳定,不易聚合。按碳的四面体结构,C-C-C键角为109°28’,而环状化合物的键角有不同程度的变形,因此产生张力。
(CH)中的2nn值-△H-1kJ.mol△S-1-1J.mol.K-△G-1kJ.mol3113.069.192.54105.155.490.0521.842.79.26-2.910.5-5.9721.415.916.3834.83.334.37环烷烃开环聚合能力为:3,4>8>5,7,九元以上的环很少见环烷烃开环聚合热力学参数(25℃)
|||有大侧基的线形大分子不稳定,易解聚成环。因为环上侧基间距大(如图a),斥力或内能小,而线形大分子上的侧基间或侧基与链中原子间的距离小(如图b和c),斥力或内能相对较大,不利于开环聚合。ba||c|无取代的和有取代的环烷烃,随着取代程度的增加,(-H)依次递减,聚合难度递增。如四氢呋喃能聚合,2-甲基四氢呋喃却不能聚合。8|2)取代基的影响环上取代基的存在不利于开环聚合
98.2杂环开环聚合热力学和动力学1)热力学因素环酯、环醚、环酰胺等杂环化合物通常比环烷烃易聚合,因为杂环中的杂原子提供了引发剂亲核或亲电进攻的位置。但聚合能力与环中杂原子的性质有关。如五元环醚(四氢呋喃)能够聚合,而五元环酯(γ-丁氧内酯)却不能聚合。相反,六元环醚(四氢吡喃、1,4-二氧六环)都不能聚合,但六元环酯(环戊内酯)却能聚合。五元和六元的环酰胺、环酐都较易聚合。
102)引发剂和动力学因素环中杂原子易被亲核或亲电活性种进攻,有利于开环。大部分离子开环聚合属于连锁机理,但有些带有逐步性质。分子量随转化率而增加,聚合速率常数接近于逐步聚合,存在有聚合-解聚平衡。离子型引发剂较活泼,包括阴离子聚合的引发剂金属Na的RO-、HO-化合物和阳离子聚合的引发剂H+、BF3等。分子型引发剂(如水)活性较低,只限用于活泼单体。杂环开环聚合的引发剂有离子型和分子型两类。
11环醚(CyclicEther),无取代的三、四、五元环醚分别称环氧乙烷、环丁氧烷、四氢呋喃,其聚合活性依次递减。醚属Lewis碱,环醚的氧原子易受阳离子进攻,一般用可阳离子引发开环。但三元环醚(环氧化合物)其环张力大,很易开环,也可用阴离子引发剂引发开环。8.3三元环醚的阴离子开环聚合工业上有价值的环醚开环聚合有:环氧乙烷、环氧丙烷的开环聚合制聚醚三聚甲醛的开环聚合制聚甲醛
CH2CH2OCHCH3CH2OCHC2H5CH2OCHCH2ClCH2O三元环氧化物的张力大,开环倾向较大,阳离子、阴离子甚至水均可使C-O键断裂而开环。阳离子开环聚合常伴有链转移反应,故工业上环氧烷多采用阴离子引发剂开环聚合。引发剂常采用氢氧化物(如NaOH)、烷氧基化合物(如CH3ONa)。12三元环氧化物主要品种:
13增长:引发:仅仅采用这些引发剂虽可使三元环氧化物聚合,但其起始端为OH或CH3O,末端或为离子对或为终止剂的基团。
为了制备多臂结构的聚合物,常以丙三醇、季戊四醇、多乙烯多胺为起试剂。14为调控聚合物的结构与性能,往往在聚合体系中加入含活泼氢的化合物作为起始剂。如:为了使端基具有疏水性,从而使聚合物具有非离子表面活性剂的特性,常以C16H33OH等长碳链化合物为起试剂。CH3−CH2−CH2⋅⋅⋅⋅⋅⋅CH2−−O(CH2CH2O)n−1CH2CH2OH疏水基亲水基
15终止剂终止(如酚类化合物)。1)环氧乙烷的阴离子开环聚合的机理和动力学以醇钠为引发剂为例,机理如下:链引发:链增长:环氧化物的开环聚合一般无链终止,需人为加入
16[M]0−[M]t[C]0Xn=[M]0和[M]t:环氧乙烷起始和t时刻的浓度;[C]0:引发剂浓度;[C]:t时刻的引发剂浓度。环氧乙烷的开环聚合虽有阴离子聚合的性质,但其分子量和转化率随时间逐步增加,又有逐步聚合的特征。聚合速率和数均聚合度为:d[M]dt
2)聚醚型表面活性剂的合成原理聚醚型表面活性剂由疏水端基和亲水的聚氧乙烯链段组成,疏水端基由特定的起始剂提供。起始剂(RXH)和环氧乙烷(EO)聚合成聚醚的通式如下:RXH+nEORX(EO)nH以OP-10[C8H17C6H4O(EO)10H]为例,辛基酚起始剂提供端基分子量为189,10单元的环氧乙烷分子量440,属于低聚物,端基所占比例不能忽略。17
起始剂环氧乙烷加成物Nwt%EOHLB烷基酚R-CHOH(C=8-9)64CH-CHO(EO)H̵91964n1.5-4020-904.6-17.8脂肪醇ROH(C=12-18)CHO(EO)H1633n2-5015-90脂肪醇ROH(C=8-18)RO(PO)(̵EO)H̵mnm>825-95脂肪酸RCOOH(C=11-17)RCOO(EO)H̵n丙二醇HOCHOH36HO(EO)-(PO)̵ab(EO)Hab=15-5610-8018改变疏水基R、连接元素X、环氧烷烃种类及聚合度n,可衍生出上万种聚醚产品。起始剂有脂肪醇、烷基酚、脂肪酸、胺类等,可形成多种聚醚型表面活性剂系列
19CH3(OE)nO-Na++ROHCH3(OE)nOH+RO-Na+交换反应形成起始剂活性种RO-Na+可再引发单体增长,聚合速率并不降低。但使原来活性链终止,导致分子量降低,聚合度为:[M]0−[M][C]0+[ROH]0Xn=聚醚型表面活性剂的合成原理遵循环氧乙烷活性阴离子开环聚合的一般规律。但除了引发、增长外,起始剂的引入,还有交换反应。如以脂肪醇ROH作起始剂,聚环氧乙烷活性种将与脂肪醇起交换反应。
~~CHCH2O-B+or~~CH2CHO-B+3)环氧丙烷的阴离子开环聚合机理和动力学环氧丙烷结构不对称,可能有2种开环方式,其中β-C(CH2)原子空间位阻较小,易受亲核进攻,成为主攻点。但2种开环方式最终产物的头尾结构却是相同的。CH3CH-CH2O||CH3CH3(主)(副)20
21CH2OCH3CHNaCH2OCH+CH3ktr.MCH2CH3OCHOH+CH2CH2CHCHCH2NaCH2ONa环氧丙烷开环易发生向单体转移反应,使分子量降低。
22=ktr,M[C][M]d[N]d[M]CM1+CM=ktr,Mkp+ktr,M−=CM:向单体转移常数d[N]dt两式相除当存在向单体链转移时,单体消失速率为:d[M]dt由转移生成的聚合物链的速率为:
23上式积分,得:([M]0−[M])CM1+CM[N]=[N]0+[M]0−[M][N]0(Xn)0=[M]0−[M][N]Xn=[N]0:无向单体转移时的聚合物浓度。有、无向单体链转移时的平均聚合度分别为:
=+1(Xn)01XnCM1+CM开环聚合的CM一般为10-2,比自由基聚合的CM大102~103倍。环氧丙烷聚合中链转移的影响很大,因此一般得不到高分子量聚合物,通常3000~4000(聚合度50~70)左右。24综合以上几式可得:
O-CH2CH2-C-CH2ClCH2Cl-O-CH2-C-CH2-|258.4环醚的阳离子开环聚合1)丁氧环(四元环醚)在0℃或较低温度下,丁氧环经Lewis酸引发,易开环聚合成聚氧化三亚甲基。但有应用价值的单体却是3,3’-二氯亚甲基丁氧环(俗称氯化聚醚),机械强度比氟树脂好,可用作工程塑料。|CH2Cln|||CH2ClBF3
26CH2CH2CH2OHOATHFAHOCH2CH2OTHFHA+CH2PTHF2)四氢呋喃(Tetrahydrofuran)的阳离子开环聚合四氢呋喃为五元环,环张力较小,对引发剂选择和单体精制要求高。五氟化磷为催化剂,分子量30万左右;以五氯化锑作催化剂,聚合速率和分子量低得多。少量环氧乙烷可作四氢呋喃开环聚合促进剂。Lewis酸直接引发四氢呋喃开环速率较慢,但易引发高活性的环氧乙烷开环,形成氧鎓离子,氧鎓离子能加速其开环聚合。
27ROR"δCδR"CROR"CRO甲醛(Formaldehyde)结构简单,既可阴离子聚合又可阳离子聚合,是这类化合物的代表。但其精制困难,往往先制成预聚物三聚甲醛,再开环聚合。8.5羰基化合物的聚合和三氧六环的阳离子聚合1)羰基化合物羰基化合物中的羰基极性较大,有异裂倾向,适合离子聚合。
28乙醛(Aldehyde)以上高级醛类,由于烷基位阻效应,聚合热降低,如乙醛聚合上限温度仅-31℃,产物分子量很低,无实用价值。另外甲基的诱导效应,使羰基氧上电子云密度增加,降低活性种稳定性。乙醛以上的高级醛类均不能聚合。丙酮(Acetone)分子上两个甲基导致的位阻效应和诱导效应,使其不能聚合。醛上氢被卤素原子取代,卤素的吸电子性,使氧上的负电荷密度分散,活性种稳定,易被弱碱引发阴离子聚合。如三氯乙醛、三氟乙醛都易聚合。
29H2COCH2OCH2OH(BF3OH)H2COCH2OHOAHOCH2OCH2OCH2AHOCH2OCH2OCH2OCH2CH2OCH2OCH2OCH2CH2OCH2OAOCH2OCH2OCH2AH2OHOCH2OCH2OCH2OCH2OCH2OH2)三氧六环(三聚甲醛)三氧六环是甲醛的三聚体,易受BF3-H2O作引发进行阳离子聚合。
OCH2OCH2OCH2OCH2OCH2+CH2O三聚甲醛开环聚合的聚合上限温度较低,存在聚甲醛-甲醛平衡现象,诱导期相当于产生平衡甲醛的时间,可通过添加适量甲醛消除诱导期,减少聚合时间。聚合结束后,聚甲醛-甲醛平衡仍然存在,若条件改变打破平衡,使聚甲醛不断解聚,失去使用价值。30
与少量二氧五环共聚,在主链中引入-OCH2CH2-链节,使聚甲醛降解直此即停止。称为共聚甲醛。31HOCH2OCH2OCH2OCH2OCH2OH(RCO)2OORCO[CH2O]nCH2OOCRCH2OCH2CH2OCH2OCH2OH改进方法:聚合结束前加入酸酐类物质,使端羟基乙酰化,防止其从端基开始解聚,称均聚甲醛。
32己内酰胺是七元杂环,有开环聚合的倾向。最终产物中线性聚合物与环状单体并存,相互构成平衡,其中环状单体约占8~10%。己内酰胺可用酸、碱或水来引发开环聚合。阳离子聚合引发时,转化率和分子量都不高,无实用价值。8.6己内酰胺的阴离子开环聚合水,合成尼龙-6纤维,属逐步聚合机理;碱金属或其衍生物,属阴离子开环聚合机理,引发后的预聚体直接浇铸入模内制成铸件,故称铸型尼龙。工业上主要采用两种引发剂:
OC(CH2)5NH+BMOC+BH(CH2)5NM(I)内酰胺阴离子与单体反应开环,生成活泼的胺阴离子(II)。332)己内酰胺的阴离子开环聚合的机理首先,己内酰胺与碱金属或衍生物反应,形成内酰胺阴离子活性种(I)。该反应为平衡反应,须真空除去副产物BH,使平衡向右移动。
34C(CH2)5NOM+C(CH2)5NHO慢C(CH2)5NOCO(CH2)5HNMC(CH2)5NOCO(CH2)5NHM+C(CH2)5NHOC(CH2)5NOCO(CH2)5NH2+COM(CH2)3N(I)(II)胺阴离子(II)无共轭作用,较活泼,很快夺取另一单体己内酰胺分子上的一质子,生成二聚体,同时再生内酰胺阴离子(I)。
35C(CH2)5NOCO(CH2)5NH2+C(CH2)3NOM(CH2)5NOCO(CH2)5NH2C(CH2)3NOMC增长反应首先是活性较高的N-酰化内酰胺与内酰胺阴离子反应,使N—酰化内酰胺开环。反应产物很快再与单体发生质子交换反应,再生成内酰胺阴离子(I)
36(CH2)5NOCO(CH2)5C(CH2)3NOMCCNH2+(CH2)3NHO(CH2)5NOCO(CH2)5C(CH2)3NOCHCNMONH2+(CH2)3己内酰胺阴离子聚合的特点:活性中心不是自由基、阴离子或阳离子,而是酰化的环酰胺键;不是单体加成到活性链上,而是单体阴离子加成到活性链上。
37C(CH2)3ONH+RCOClOC(CH2)3NOCR+HCl己内酰胺的开环聚合速率与单体浓度无关,而与活化单体(内酰胺阴离子)浓度有关,即与引发剂碱性物质浓度有关。酰化的内酰胺较活泼,为活性中心,可采用酰氯、酸酐、异氰酸酯等酰化剂与单体反应,使己内酰胺先形成N-酰化己内酰胺,消除诱导期,加速反应,缩短聚合周期。
ClCH3CH3SiClH2O,HClHOCH3CH3SiOHH2OCH3[OCH3Si]n氯硅烷水解速率很快,生成的中间产物硅醇难以分离。碱性条件下水解时有利于形成分子量较高的线性聚合物;酸性条件下水解有利于形成环状或低分子量线性聚合物。388.7聚硅氧烷的开环聚合聚硅氧烷属半有机高分子,具有耐高温、耐化学品的特点,主要产品有硅油、硅橡胶和硅树脂。原料是氯硅烷,如二甲基二氯硅烷。
39种,环状单体插入(OSiR2)3OnSiR2[OR碱金属的氢氧化物或烷氧化物是环状硅氧烷的常用阴离子引发剂,可使硅氧键断裂,形成硅氧阴离子活性Si]4nOM离子键中增长。酸性条件下水解形成的环状硅氧烷一般为八元环(八甲基环四硅氧烷,D4)或六元环(六甲基环三硅氧烷,D3),再经过阳离子或阴离子开环聚合,可得到超高分子量的聚硅氧烷,用作硅橡胶。R
40强质子酸或Lewis酸也可使硅氧烷开环聚合,活性种是硅阳离子,环状单体插入增长;也可形成氧鎓离子后重排成硅阳离子。SiR2OAM+SiR2(OSiR2)3OA(SiR2O)3SiR2OMM+SiR2(OSiR2)3O(SiR2O)4SiR2OMSi(R2)A
Thanks!41国家级精品课程──高分子化学'
您可能关注的文档
- 《桃花源记》推荐课件PPT.ppt
- 《用比例解决问题》课件PPT30971.ppt
- 二年级语文下册《蜜蜂引路》课件PPT.doc
- 辛弃疾《青玉案.元夕》课件PPT.ppt
- 二年级6的乘法口诀教学课件PPT.ppt
- 垂径定理课件PPT.ppt
- 教学课件PPT模板课件.ppt
- 二下识字6课件PPT.ppt
- 窝沟封闭_课件PPT.ppt
- 上消化道出血示例课件PPT.ppt
- 感恩父母课件PPT43594.ppt
- 消化和吸收课件PPT.ppt
- 北师大版数学二年级下册《分草莓》课件PPT版.ppt
- C#课件PPT课程资料教学作者二第2章 语言基础.ppt
- JavaScript程序设计案例教程第2版许旻配套教学课件PPT第9章.ppt
- Painter12中文版案例教程 教学全套课件PPT课件 第5章.ppt
- Painter12中文版案例教程 教学全套课件PPT课件 第3章.ppt
- Painter12中文版案例教程 教学全套课件PPT课件 第4章.ppt