- 1.53 MB
- 2022-04-29 14:42:07 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'《电解池的工作原理与应用》PPT课件
一、电解的有关概念1.定义:电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫电解。把电能转变为化学能的装置。4.电解池:2.组成:①直流电源(电流)②电解质溶液或熔融电解质③两个电极④形成闭合回路3.电极:阳极:与电源正极相连的电极阴极:与电源负极相连的电极5.放电:阴阳离子在电极失去或获得电子发生氧化或还原反应的过程(氧化反应)(还原反应)(也叫电解槽)
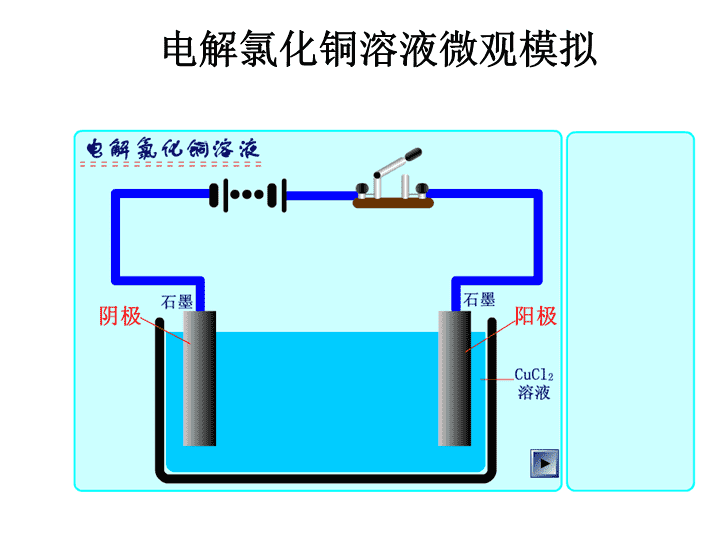
电解氯化铜溶液微观模拟
电极材料不论是活性还是惰性,电极材料均不发生反应,只存在阳离子在此放电。阴极区阳离子放电顺序Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
清楚离子的移动趋向比较离子的放电能力,然后根据阴极还原、阳极氧化得出电极产物e-e-e-e-e-还原反应氧化反应阳离子明确电解质溶液中或熔融态电解质中存在的离子阴离子特别注意:如果阳极是活性电极,则电极自身反应,离子不放电分析电解过程步骤
练习1:(07江苏)某同学按右图所示的装置进行电解实验。下列说法正确的是(双选)A.电解过程中,铜电极上有H2产生B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑C.电解一定时间后,石墨电极上有铜析出D.整个电解过程中,H+的浓度不断增大√√
练习2:某同学在做电解水的实验时发现两极产生气泡的速率特别缓慢,(水是一种极弱的电解质,导电能力很差)你能否在不改变两电极产物的情况下,加入某种物质使其加快电解速率?NaNO3Na2SO4等
练习2:某同学在做电解水的实验时发现两极产生气泡的速率特别缓慢,(水是一种极弱的电解质,导电能力很差)你能否在不改变两电极产物的情况下,加入某种物质使其加快电解速率?NaNO3Na2SO4等
2、电解无氧酸(HF除外)阳极:阴极:总反应:HCl溶液1、电解不活泼金属的无氧酸盐溶液阳极:阴极:总反应:CuCl2溶液二、用惰性电极进行电解的规律CuCl2Cu+Cl2↑2Cl——2e—=Cl2↑Cu2++2e—=Cu溶液pH值: 如何复原:增大加CuCl2固体2Cl——2e—=Cl2↑2H++2e—=H2↑2HCl H2↑+Cl2↑溶液PH值: 如何复原:增大通入HCl气体电解类型为:电解电解质型恢复电解质溶液原浓度的方法:将两极产物(脱离电解质溶液)发生反应的物质即为所需加入的物质
3、电解含氧酸阳极:阴极:总反应:4OH—-4e—=2H2O+O2↑4H++4e—=2H2↑2H2O 2H2↑+O2↑溶液PH值: 如何复原减小加水H2SO4溶液4OH——4e—=2H2O+O2↑4H++4e—=2H2↑2H2O 2H2↑+O2↑溶液PH值: 如何复原增大加水4、电解可溶性强碱溶液阳极:阴极:总反应:NaOH溶液
4OH——4e—=2H2O+O2↑4H++4e—=2H2↑2H2O 2H2↑+O2↑溶液PH值: 如何复原不变加水5、电解活泼金属含氧酸盐溶液阳极:阴极:总反应:K2SO4溶液电解类型:电解水型2Cl——2e—=Cl2↑2H++2e—=H2↑2NaCl+2H2O2NaOH+H2↑+Cl2↑溶液PH值: 如何复原增大通入HCl气体6、电解活泼金属的无氧酸盐溶液阳极:阴极:总反应:NaCl溶液电解类型:放氢生碱型
7、电解不活泼金属的含氧酸盐溶液阳极:阴极:总反应:4OH——4e—=2H2O+O2↑2Cu2++4e—=2Cu2CuSO4+2H2O2Cu+2H2SO4+O2↑溶液PH值: 如何复原减小加CuOCuSO4溶液电解类型:放氧生酸型练习:【2004广东】pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是A.NaOHB.H2SO4C.AgNO3D.Na2SO4√
用惰性电极电解熔融盐电解熔融的Al2O3电解熔融的NaCl阳极:阴极:总反应:6O2-—12e—=3O2↑4Al3++12e—=4Al阳极:阴极:总反应:2Cl-—2e—=Cl2↑2Na++2e—=2Na2Al2O3(熔融)4Al+3O2↑2NaCl(熔融)2Na+Cl2↑
三、电解应用:1、电冶金特别活泼的金属钠、镁、铝等只能通过电解的方法制取为什么不电解钠、镁、铝的盐溶液?2Al2O3==4Al+3O2↑通电熔融MgCl2==Mg+Cl2↑通电熔融2NaCl==2Na+Cl2↑通电熔融AlCl3?MgO?
(1)金属冶炼的本质与方法本质:Mn++ne-=M方法:电解法、热还原法、热分解法、物理富集法KCaNaMgAlZnFeSnPbCuHgAgPtAu电解法热还原法热分解法物理富集法(2)电冶金(电解法)本质:利用电解原理,电解熔融的金属化合物,两极强制氧化还原冶炼范围:K、Ca、Na、Mg、Al举例:
铝电解槽阳极C电解质钢壳烟罩熔融态铝钢导电棒阴极C耐火材料
2、氯碱工业+-精制饱和NaCl淡盐水Cl2H2NaOH溶液H2O含少量NaOHCl-Cl2H2OH-Na+Na+交换膜电解饱和食盐水的原理示意图2H++2e-=H2↑2Cl--2e-=Cl2↑阳阴H+从何来?优点:防止阴极产生的氢气和阳极产生的氯气混合爆炸避免氯气和NaOH作用生成NaClO而影响烧碱质量
3、电镀1)定义:利用电解原理,在某些金属表面镀上一层其他金属或合金的过程。镀层金属:通常是一些在空气或溶液中不易起变化的金属(如:铬、镍、银)和合金(黄铜)目的:使金属增强抗腐蚀的能力,增加美观和表面硬度工艺:把待镀金属制品作阴极,镀层金属作阳极,用含有镀层金属离子的电解质溶液作电镀液。
2)装置硫酸铜溶液阳极:Cu—2e-=Cu2+阴极:Cu2++2e-=Cu3)电镀材料的选择:阴极——镀件阳极——镀层金属电镀液——含有镀层金属离子的溶液4)电镀的结果,电镀液的浓度保持不变铜镀件规律:一少一多一不变
4、电解精炼铜利用电镀原理,铜上镀铜阳极:阴极:电解液:粗铜(含Zn、Fe、Ni、Ag、Pt、Au)纯铜粗铜纯铜CuSO4溶液电极反应:阳极(粗铜):阴极:CuSO4溶液比铜活泼,先放电Zn-2e-=Zn2+Fe-2e-=Fe2+Ni-2e-=Ni2+Cu-2e-=Cu2+Cu2++2e-=Cu比铜活泼性差的Ag、Pt、Au不溶解,以单质形式沉积于电解槽的底部,形成阳极泥,可回收提炼贵重金属。纯度可高达99.95%~99.98%
3、铜的电解精炼粗铜:含杂质(Zn、Fe、Ni、Ag、Au等)阳极:Zn-2e-=Zn2+Fe-2e-=Fe2+Ni-2e-=Ni2+Cu-2e-=Cu2+ZnFeNiCuAgAu阴极:Cu2++2e-=Cu阳极泥问:电解完后,CuSO4溶液的浓度有何变化?粗铜纯铜硫酸铜溶液
电离与电解的比较电解质溶于水或熔化状态下电解质电离后,再通以直流电电解质电离成为自由移动的离子阴阳离子定向移动,在两极上放电CuCl2=Cu2++2Cl-CuCl2=Cu+Cl2电解电解必须建立在电离的基础上
正极负极还原反应氧化反应还原反应氧化反应先从负极→导线→正极负极→导线→阴极阳极→导线→正极阴极阳极将化学能转化为电能将电能转化为化学能原电池与电解池的比较
2.用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后()A.溶液的pH变大B.c(Na+)与c(CO32-)的比值变大C.溶液浓度变大,有晶体析出D.溶液浓度不变,有晶体析出巩固练习:1.在电解水时,常加入一些稀硫酸,其目的是A.使溶液酸性增强B.使溶液中离子浓度增大C.加快电解的速率D.使溶液的氧化性增强CD
3.铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标况下)气体.求电解后溶液的C(H+)。Cu2+得电子数+H+得电子数=OH-失电子总数解析:阳极4OH--4e-=2H2O+O2↑阴极Cu2++2e-=Cu2H++2e=H2↑n(Cu2+)×2+0.5×2=0.5×4n(Cu2+)=0.5molCu2+~2H+C(H+)=1mol/L
稀H2SO4Cu石墨4.(2007·江苏高考·11)某同学按图所示的装置进行电解实验,下列说法正确的是()(A)电解过程中,铜电极上有H2产生(B)电解初期,主反应方程式为:Cu+H2SO4=CuSO4+H2↑(C)整个电解过程中,H+的浓度不断增大(D)电解一定时间后,石墨电极上有铜析出BD
4.在25℃时.将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阴极逸出a摩气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量分数是()A.B.C.D.
电解原理(09安徽卷12)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,电解总反应:2Cu+H2O==Cu2O+H2O。下列说法正确的是A.石墨电极上产生氢气B.铜电极发生还原反应C.铜电极接直流电源的负极D.当有0.1mol电子转移时,有0.1molCu2O生成。
(燃料电池)(09广东化学14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变D.电池工作时,电子通过外电路从正极流向负极
(化学电源)(09山东卷29)(12分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。(1)该电池的负极材料是。电池工作时,电子流向(填“正极”或“负极”)。(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是。欲除去Cu2+,最好选用下列试剂中的(填代号)。a.NaOHb.Znc.Fed.NH3·H2O(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是。若电解电路中通过2mol电子,MnO2的理论产量为。
(09山东卷29)答案:(1)Zn(或锌)正极(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀b(3)2H++2e-→H2,87g
第13周移多补少二年级奥数举一反三
第13周移多补少王牌例题1小明有16个贝壳,小红有12个贝壳。小明给小红几个贝壳,两人贝壳个数就会同样多?16-12=4(个)4÷2=2(个)
第13周移多补少举一反三1小红有10支铅笔,小明有6支铅笔。小红给小明几支铅笔,两人铅笔数量就会同样多?
第13周移多补少举一反三1二(1)班第一队有28人,第二队有36人,怎样调整两队人数就会同样多?
第13周移多补少举一反三1甲筐比乙筐多10棵白菜,从甲筐拿几棵到乙筐,甲乙两筐的白菜棵树就会同样多?
第13周移多补少王牌例题2文文和飞飞各有一些画片,飞飞给文文3张后,两人画片同样多,原来飞飞比文文多几张?3×2=6(张)飞飞文文移动数相差数
第13周移多补少举一反三2小华给小强2支铅笔,两人铅笔数量同样多,原来小华比小强多几支铅笔?
第13周移多补少举一反三2二(1)班有60名小朋友排两队做操,从第一队调4人到第二队,两队人数同样多,原来第一队比第二队多几人?
第13周移多补少举一反三2肖肖给飞飞6根小棒后,两人小棒数量一样多,原来肖肖比飞飞多几根小棒?
第13周移多补少王牌例题3哥哥有22张邮票,他给弟弟4张后,两人邮票张数同样多,弟弟原来有几张邮票?4×2=8(张)22-8=14(张)移动数相差数×2=
第13周移多补少举一反三3小红有10张画片,她给小明2张后,两人画片张数同样多,小明原来有几张画片?
第13周移多补少举一反三3小英做了15朵纸花,她给小兰3朵后,两人纸花的朵数同样多,小兰原来做了多少朵?
第13周移多补少举一反三3甲借3本书给乙后,两人书的本书一样多,这时乙有12本书,问甲原来有几本书?
第13周移多补少王牌例题4二(1)班有46人,二(2)班有42人,新学期又转来了8个同学,应该怎样分配,两班人数就可以相等?46-42=4(人)8-4=4(人)4÷2=2(人)4+2=6(人)
第13周移多补少举一反三4体育课上同学们排成两队,第一队26人,第二队20人,又来了8人,应该怎样分,才能使两队的人数相等?
第13周移多补少举一反三4李青家有一个书架,书架共分为3层,上层32本,中层26本,下层20本,若书的总本数不变,怎样使三层书架上的书本数相等?
第13周移多补少举一反三4小伟家的书架上有3层书,上层32本,中层28本,下层24本,怎样移动才能使上中下三层书架上的一样多?
第13周移多补少王牌例题5一个书架有两层。如果从上层取10本书到下层,上层比下层多5本。原来上层比下层多几本?
第13周移多补少举一反三5芳芳和南南有一些糖,芳芳给南南5块后,芳芳比南南还多2块。原来芳芳比南南多几块?
第13周移多补少举一反三5小林有一个两层的文具盒,上层比下层多4支笔,如果下层拿一支笔到上层,这时上层比下层多几支?
第13周移多补少举一反三5甲乙两堆萝卜,甲堆比乙堆多8个萝卜,如果从甲堆拿5个到乙堆,这时哪堆萝卜多?多几个?'
您可能关注的文档
- 最新《用7、8、9的乘法口诀求商-》PPT课件PPT课件.ppt
- 最新《用7、8的乘法口诀求商》教学课件课件PPT.ppt
- 最新《生物的睡眠》课件.课件PPT.ppt
- 最新《生物入侵者》ppt课件课件PPT.ppt
- 最新《电力线载波通信》1-1课件PPT.ppt
- 最新《用计算器计算》课件PPT课件.ppt
- 最新《用计算器计算》课件课件PPT.ppt
- 最新《用转化的策略解决问题》ppt课件课件PPT.ppt
- 最新《用牛顿运动定律解决问题(二)》ppt课件PPT课件.ppt
- 最新《电生磁》课件3课件PPT.ppt
- 最新《番茄太阳》ppt课件PPT.ppt
- 最新《百分数的应用》(一)PPT课件PPT课件.ppt
- 最新《百分数与分数、小数的互化》精品课件(习题版)课件PPT.ppt
- 最新《白说》好书推荐ppt课件PPT.ppt
- 最新《登高》ppt课件课件PPT.ppt
- 最新《盐类水解的应用》课件PPT课件.ppt
- 最新《石油钻采新装备》(井控设备)课件PPT.ppt
- 最新《石灰吟》-(1)精品PPT课件PPT课件.ppt