- 775.50 KB
- 2022-04-29 14:42:24 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'
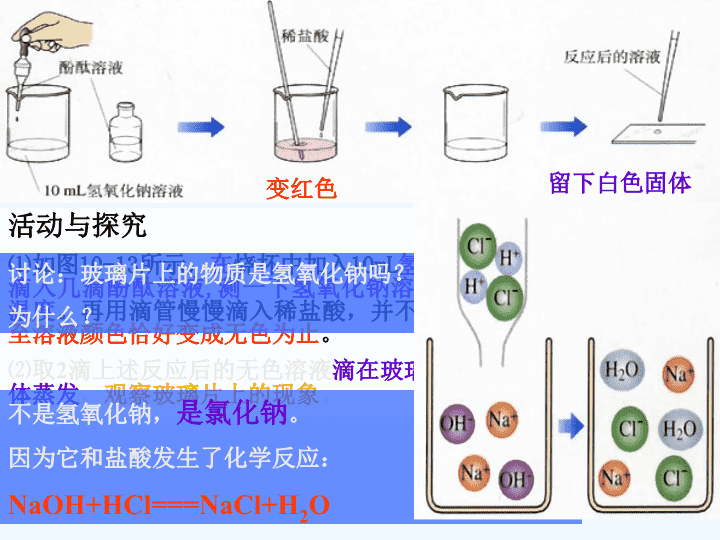
酸和碱中和反应
活动与探究⑴如图10-13所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液,测一下氢氧化钠溶液及稀盐酸的温度。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。⑵取2滴上述反应后的无色溶液滴在玻璃片上,使液体蒸发,观察玻璃片上的现象。变红色留下白色固体讨论:玻璃片上的物质是氢氧化钠吗?为什么?不是氢氧化钠,是氯化钠。因为它和盐酸发生了化学反应:NaOH+HCl===NaCl+H2O
恰好完全反应后反应前酸性碱性中和反应的微观示意图中性中和反应能改变溶液的酸碱性!消失的粒子:生成的粒子:中和反应的微观实质:H++OH-——H2OH+、OH-H2O分子
练习:写出下列反应的化学方程式2KOH+H2SO4==K2SO4+2H2OCa(OH)2+2HCl==CaCl2+2H2OCu(OH)2+H2SO4==CuSO4+2H2O思考:这三成上有什么种物质在组共同点?
1.盐:含有金属离子和酸根离子的化合物,叫做盐。2.中和反应:酸与碱作用生成盐和水的反应,叫做中和反应。如氯化钠、氯化钙、硫酸铜等,都属于盐。2HCl+Ca(OH)2====CaCl2+2H2OH2SO4+2NaOH====Na2SO4+2H2O盐→金属离子+酸根离子CuSO4==Cu2++SO42-NaCl==Na++Cl-CaCl2==Ca2++2Cl-笔记注意:中和反应是放热反应。
二、中和反应在实际中的应用1.改变土壤的酸碱性可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性。人们将熟石灰加入土壤以中和酸性。2.处理工厂的废水例如,硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。你能写出该反应的化学方程式吗?H2SO4+Ca(OH)2====CaSO4+2H2O因为熟石灰价格便宜,处理污水成本低。
3.用于医药⑴人的胃液里含有适量的盐酸,可以帮助消化。胃酸过多,可以服用碱性物质的药物,以中和过多的胃酸。如胃药“胃舒平”中含有氢氧化铝也可服小苏打(碳酸氢钠)——NaHCO3⑵蚊虫能分泌出蚁酸,从而使皮肤肿痛。如果涂一些含有碱性物质(如肥皂水或NH3·H2O)等药水,就可以减轻痛庠。3HCl+Al(OH)3====AlCl3+3H2OHCl+NaHCO3====NaCl+H2O+CO2↑讨论:举出生活中利用中和反应的实例。
学完本课题你应该知道1、酸和碱能发生中和反应,生成盐和水。2、酸碱中和反应在生活和生产中有广泛的应用。3、盐是在水溶液中能解离出金属离子和酸根离子的化合物
复习巩固:1.用适量盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去垢的原理,写出有关的化学方程式。2.如果将实验室残留的盐酸直接倒入下水道,会造成什么危害?应如何处理废盐酸?Mg(OH)2+2HCl=MgCl2+2H2OCaCO3+2HCl=CaCl2+CO2↑+H2O盐酸将不溶性的Mg(OH)2和CaCO3生成可溶性的氯化镁和氯化钙而便于洗去。下水道若为金属管道,盐酸会使其腐蚀;并污染水。应将废盐酸倒入废液缸统一处理。
复习巩固:3.有些胃药中含有氢氧化铝[Al(OH)3],它在人的胃内起什么作用?试写出反应的化学方程式。4.一些国家正在试用碳酸水浇灌某些植物,其作用是()A.调节土壤的pH,改良酸性土壤B.调节土壤的pH,改良碱性土壤C.促进植物的光合作用D.在植物上方形成温室Al(OH)3+3HCl=AlCl3+3H2OBCAl(OH)3能中和胃中过量的盐酸碳酸并能分解放出CO2
复习巩固:5.下列反应中,肯定能生成水的是()A.化合反应B.中和反应C.分解反应D.置换反应B6.下列关于物质的用途的叙述不正确的是()A.盐酸可用来除铁锈B.稀硫酸在实验室里常用作干燥剂C.氢氧化钠可用作制肥皂和造纸工业D.熟石灰可用来改良酸性土壤B×
复习巩固:7.如右图所示,小田同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小田从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是她得出“两种物质已恰好完全中和”的结论。⑴你认为她得出的结论是否正确_________,理由是___________________________⑵请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表。如果盐酸过量,滴入酚酞试液也不会变色不正确试液变红色酸过量⑴取样,滴入紫色石蕊试液
复习巩固:8.实验室有部分变质的氢氧化钠固体。现取该固体样品10g,加入100g稀盐酸中,恰好完全反应,反应后溶液的质量为107.8g。求:⑴生成气体的质量。⑵该样品中氢氧化钠的质量。解:生成CO2的质量为10g+100g-107.8g=2.2g设样品中有碳酸钠的质量为xNa2CO3+2HCl==2NaCl+H2O+CO2↑10644x2.2g106x44——=——2.2gX=————=5.3g106×2.2g44氢氧化钠的质量为10g-5.3g=4.7g答:生成CO22.2g,样品中有NaOH4.7g。2NaOH+CO2===Na2CO3+H2O
谢谢各位同学的合作学习!再见'
您可能关注的文档
- 《动物儿歌》课件PPT.ppt
- 语文人教版四年级上册去年的树.语文课件PPT.ppt
- 《要下雨了》教学课件PPT.ppt
- 虚拟仪器_labview_课件PPT_第七章_波形显示.ppt
- 《操场上》课件PPT.ppt
- 《荷叶圆圆》课件PPT.ppt
- 分数加减混合运算课件PPT.ppt
- 去年的树.语文课件PPT.ppt
- 文具的家课件PPT.ppt
- 语文苏教版三年级上册《孙中山破陋习》教学课件PPT.ppt
- 《数字电子技术基础》第五版 阎石 第8章 课件PPT.ppt
- 《数字电子技术基础》第五版 阎石 第7章 课件PPT.ppt
- 语文苏教版二年级下册《学棋》教学课件PPT.ppt
- 首字母填空课件PPT.ppt
- 之几是多少的应用题课件PPT下载 苏教版五年级数学下.ppt
- 《物体的浮沉条件及其应用》课件PPT.ppt
- 部编教材语文第二册第14课《 要下雨了》课件PPT.ppt
- 物理人教版八年级上册《声音的产生与传播》教学课件PPT.ppt