- 2.61 MB
- 2022-04-29 14:20:33 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中考生物复习课件34人体内代谢废物的排出ppt
栏目索引考情分析知识梳理知识体系考点剖析实战演练
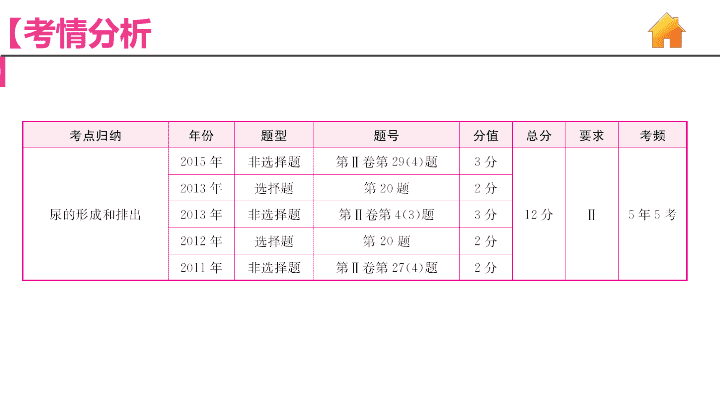
【必考考点】(3)尿液的形成。
①尿液的形成。a.血液流经肾单位时,由于肾小球和肾小囊内壁的______作用,在肾小囊腔中形成________。b.原尿流经肾小管时,由于肾小管的__________作用,从肾小管末端流出的液体是____________。c.肾小管从原尿中重吸收的成分是全部的____________,大部分的____________,部分____________等。滤过原尿重吸收尿液葡萄糖水无机盐
②血液、血浆、原尿、尿液成分比较。与血液相比较原尿中不含_________________________;与血浆相比较原尿中不含_______________________;与原尿相比较尿液中不含____________。③血液、血浆、原尿、尿液共有的成分是____________________________。④血液流经肾脏后,血液成分的主要变化是______________________________________。血细胞和大分子蛋白质大分子蛋白质葡萄糖水、无机盐、尿素、尿酸动脉血变成静脉血,尿素的含量明显减少
(4)尿液的排出。__________→输尿管→___________→尿道→体外。肾膀胱
(5)尿检异常情况。①若某人出现血尿或蛋白尿,可能是肾脏的__________发生病变。②若某身体健康的人,因过量服用糖,尿液中出现葡萄糖,说明__________的重吸收能力是有限的。③__________(填激素名称)分泌不足,会形成糖尿。肾小球肾小管胰岛素
【常考考点】2.汗液的形成和排出(1)皮肤的结构。
①表皮:由__________组织构成,分为__________和__________。__________细胞脱落会形成皮屑,__________细胞可以分裂产生新细胞,与皮肤再生有关。②真皮:主要由__________组织构成,含有大量的弹性纤维和胶原纤维,使皮肤具有一定的弹性和韧性。注:表皮和真皮的主要区别是表皮内无__________和__________________。上皮角质层生发层角质层生发层结缔血管感觉神经末梢
(2)汗液的形成和排出。意义:排出代谢废物,调节__________。3.人体的主要排泄途径(1)排尿:绝大部分水、无机盐和尿素以尿液的形式通过____________排出。体温泌尿系统
(2)排汗:一部分水和少量的无机盐和尿素以汗液的形式由____________排出。(3)呼吸:二氧化碳和少量的水以气体的形式通过____________排出。皮肤呼吸系统
常考点提示:1.①肾小球内流动脉血,肾小囊腔内是原尿。②原尿与血浆的区别是原尿内无大分子蛋白质,尿液与原尿的区别是尿液中无葡萄糖。③当尿液中有血细胞和蛋白质时是肾小球发生了病变。④流出肾的血液与流入肾的血液相比,主要变化是动脉血变成静脉血,尿素含量减少。2.排便≠排泄:排便排出的是食物残渣,排泄排出的是代谢废物。3.具有滤过作用的结构不仅指肾小球,也包括肾小囊内壁。4.每天形成的原尿很多,由于肾小管的重吸收作用,形成的尿液却只有原尿的1%。
点击图片放大观看
【考点1】尿液的形成和排出
例1(2015·四川乐山)在正常情况下,人体内尿的形成过程中,不可能出现的情况是()A.出球小动脉与入球小动脉中的血液都含有尿素B.大分子蛋白质经肾小球过滤到肾小囊中C.重吸收作用发生在原尿流经肾小管时D.在尿液中检测不到葡萄糖
解析:从出球小动脉流出的血液(因为没有发生气体交换,含氧量没有减少,仍然是动脉血)中蛋白质等大分子的物质的浓度会明显升高,是因为血液中的一部分水滤过到了肾小囊腔内。而出球小动脉中含有的尿素等废物与入球小动脉中的差别不大,A正确;血液流经肾小球时,除血细胞和大分子蛋白质外,都能滤过到肾小囊腔中,形成原尿,B错误;原尿流经肾小管时会发生重吸收作用,C正确;肾小管的重吸收作用会把全部的葡萄糖重吸收,所以尿液中没有葡萄糖,D正确。答案:B
例2(2012·山东济南)下表数据是取自人体内不同部位液体成分的分析结果(克/100毫升)。样品③是()A.血液B.血浆C.原尿D.尿液
解析:尿液区别于原尿和血浆的主要特点是没有葡萄糖。样品①中蛋白质含量高,有葡萄糖;样品②有葡萄糖,所以样品①②都不是尿液。样品③中没有葡萄糖,是尿液。答案:D解题技巧:
例3(2015·山东济南)下图为人体新陈代谢示意图,其中A~E表示相关的组织、器官或系统,a~d表示相关物质,①②表示生理过程。请分析回答问题:
(1)淀粉在A系统内最终被分解成c__________进入B,①表示____________过程。(2)若C表示肺泡,则过程②是通过___________实现的;经过B和组织细胞之间的气体交换,血液中___________的含量增高。
(3)在B系统内,瓣膜起到阻止血液倒流的作用,如心室与动脉之间有____________。(4)物质d的形成包括____________和____________两个生理过程。若某人尿液中含有血细胞,你推测可能是____________出现病变。
解析:根据所学的知识分析可知:A系统是食物进入体内的系统判定为消化系统,能将淀粉最终分解为葡萄糖,进入到循环系统,在图示中①是在消化系统中食物的营养成分进入血液循环的过程,代表吸收过程;B系统是循环系统,通过模式图也可以看出该系统把几个系统有机的联系到一起,是因为它具有运输功能。心室和动脉之间有动脉瓣。C表示肺泡,肺泡是空气与人体进行交换的场所,通过呼吸运动实现。血液流经组织细胞时,与组织细胞之间进行气体交换,血液中的二氧化碳含量增高。D能排出汗,是皮肤。E系统是形成尿的,是泌尿系统。d为尿液,尿液的形成包括滤过作用和重吸收作用,肾小球和肾小囊内壁有滤过作用,除了血细胞和大分子的蛋白质以外,血浆中的一部分水、无机盐、葡萄糖、尿素等物质都可以滤过到肾小囊腔内,形成原尿。出现血细胞可能是肾小球出现病变。
答案:(1)葡萄糖吸收(2)呼吸运动二氧化碳(3)动脉瓣(4)滤过作用重吸收作用肾小球解题技巧:牢记两个尿液形成的过程:滤过和重吸收。除了血细胞和大分子的蛋白质外,其余物质由肾小球和肾小囊内壁滤过,形成原尿。全部葡萄糖、大部分的水和部分无机盐由肾小管重新吸收回血液。
【考点2】汗液的形成和排出
例4下列关于皮肤的结构和功能的说法没有科学依据的是()A.表皮的生发层细胞中有一些黑色素细胞,能产生黑色素B.皮肤被划破后感到疼痛,说明已伤及至生发层内的感觉神经末梢C.真皮内含有大量的弹性纤维和胶原纤维,使皮肤柔韧而富有弹性D.真皮内含有丰富的血管,参与体温调节
解析:皮肤包括表皮和真皮。表皮包括角质层和生发层。角质层细胞排列紧密,有保护作用;生发层内有黑色素细胞,能产生黑色素,可吸收紫外线,保护内部组织免受损伤。真皮内含有大量的弹性纤维和胶原纤维,使皮肤柔韧而富有弹性;真皮内分布着丰富的感觉神经末梢,如果感觉到疼痛,说明伤口已经伤及真皮;真皮内有大量的毛细血管,可以调节体温。答案:B
谢谢观看!
专题2
从海水中获得的化学物质
第一单元氯溴碘及其化合物知识目标①氯气的工业制法-----a(了解)②氯气的实验室制法-----b(理解)③氯气的物理性质及用途-----a(了解)④氯气的化学性质(跟某些金属、H2、H2O、碱的反应),Cl—的检验-----c(应用)⑤溴、碘单质的物理性质-----a(了解)⑥氯、溴、碘单质间的置换反应---b(理解)
一、氯、溴、碘的提取(一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业我国主要以海盐为原料。海盐中含硫酸钙、硫酸镁、氯化镁等杂质,要净化后制成饱和食盐水再电解。2NaCl+2H2O==2NaOH+H2↑+Cl2↑氢气和氯气混合后在光照或点燃等情况下易爆:H2+Cl2====2HCI,氯气有毒,所以,电解的产物氯气和氢气必须隔离,且要防止氯气泄漏。通电光或点燃
(二)从海水中提取溴的常见工艺①浓缩并酸化海水后,通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2=Br2+2NaCl②向含溴单质的水溶液中通空气和水蒸汽,将溴单质吹入盛二氧化硫溶液的吸收塔内以达到富集的目的:Br2+SO2+2H2O==2HBr+H2SO4(也可用NaOH或Na2CO3溶液吸收)③向吸收塔内的溶液中通入适量的氯气:2HBr+Cl2==2HCl+Br2④用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
(三)从海洋植物中提取碘的主要工艺①用水浸泡海带或海藻灼烧后的灰烬②向水中通入适量的氯气,使碘离子转化为碘单质:2NaI+Cl2==I2+2NaCl③过滤,用有机溶剂萃取碘单质。
二、氯、溴、碘的性质和用途(一)氯气的性质和用途①原理:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O②装置:固液加热型③除杂气体:常用饱和食盐除氯化氢杂质,用浓硫酸洗气来除去水蒸气。④收集:向上排空气法或排饱和食盐水法收集。⑤验满:湿润的淀粉-碘化钾试纸等⑥尾气吸收:NaOH溶液。
1、物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体。能溶于水,有毒。2、化学性质:氯原子易得电子,是活泼的非金属元素。与金属、非金属等发生氧化还原反应,一般作氧化剂。与水、碱溶液则发生自身氧化还原反应,既作氧化剂又作还原剂。
拓展1:氯水氯水为黄绿色,所含Cl2有少量与水反应(Cl2+H2O=HCl+HClO),大部分仍以分子形式存在,氯水的主要溶质是Cl2。新制氯水含Cl2、H2O、HClO、H+、Cl-、ClO-、OH-等微粒。拓展2:次氯酸次氯酸(HClO)是比H2CO3还弱的酸,溶液中主要以HClO分子形式存在。性质:①易分解(2HClO==2HCl+O2↑),光照时会加速。②是强氧化剂:能杀菌;能使某些有机色素褪色。拓展3:漂白粉次氯酸盐比次氯酸稳定,易保存,工业上以Cl2和石灰乳为原料制成漂白粉;漂白粉的有效成分【Ca(ClO)2】,须和酸(或空气中CO2)作用产生次氯酸,才能发挥漂白作用。
(二)溴、碘的性质和用途溴碘物理性质深红棕色,密度比水大的液体,强烈刺激性气味,易挥发,强腐蚀性。紫黑色固体,易升华。气态碘在空气中显深紫红色,有刺激气味。在水中溶解度很小,易溶于酒精、四氯化碳等有机溶剂化学性质能与氯气反应的金属、非金属一般也能与溴、碘反应,只是反应活性不如氯气。氯、溴、碘单质间能够发生置换反应:氯能把溴和碘从它们的卤化物中置换出来,溴能把碘从它的卤化物中置换出来,即氯、溴、碘的氧化性强弱为:Cl2>Br2>I2用途染料、防爆剂、胶卷感光材料、杀虫剂、红药水、镇静剂,催泪性毒剂等。重要的化工原料。配碘酒和碘化物,食用盐中加KIO3,碘化银制造相底片和人工降雨。
反应方程式现象铁丝在氯气中点燃产生大量棕红色的烟,反应结束后向集气瓶中加入少量的水,可以观察到溶液呈__色。铜丝在氯气中点燃产生大量的棕黄色的烟,反应结束后向集气瓶中加入少量的水,可以观察到溶液呈__色。氢气在氯气中点燃氢气在氯气中____地燃烧,火焰呈____色,瓶口有____。氢气和氯气混合气体光照混合气体经强光照射,发生____2Fe+3Cl2===2FeCl3点燃Cu+Cl2===CuCl2点燃H2+Cl2=2HCl点燃H2+Cl2=2HCl光照黄蓝安静苍白白雾爆炸性质1、在回顾氯气与金属的反应中,是否存在一定的规律?2、从氯气与氢气的反应中你又发现了什么?
三、氧化还原反应氧化还原反应中氧化剂和还原剂、氧化产物和还原产物等概念-----b氧化还原反应中电子转移的方向和数目-------b
三、氧化还原反应1、氧化还原反应的有关概念氧化还原反应的实质:发生电子转移(电子的得失或电子对的偏移)。氧化剂+还原剂=还原产物+氧化产物2、氧化还原反应的一般规律同一反应中:①氧化反应与还原反应同时发生,相互依存。②氧化剂得电子总数与还原剂失电子总数相等。即氧化剂化合价降低总数与还原剂化合价升高总数相等。化合价降低+ne-被还原化合价升高-ne-被氧化
3、氧化还原反应中电子转移的表示方法(双线桥法)书写要求:①箭头是由反应物中的某一元素指向对应的生成物中的同一元素。②一定要标出得、失电子的总数,并且数值相等。
第二单元钠、镁及其化合物2.钠、镁及其化合物①钠的物理性质----a②钠、镁的化学性质(跟非金属、酸、某些氧化物的反应)-----b③钠、镁的生产原理-----a④碳酸钠的性质(跟酸、碱、盐的复分解反应)---b⑤碳酸钠的用途-----a⑥强弱电解质,离子反应的本质及发生的条件----b⑦离子方程式-------b
第二单元钠、镁及其化合物一、钠的原子结构及性质1、结构:钠原子最外层只有一个电子,化学反应中易失去电子而表现出强还原性。2、物理性质:质软、银白色,有金属光泽的金属,具有良好的导电导热性,密度比水小,比煤油大,熔点较低。3、化学性质:与非金属单质:钠在常温下切开后表面变暗:4Na+O2=2Na2O(灰白色)钠在氯气中燃烧,黄色火焰,白烟:2Na+Cl2====2NaCl点燃
与水反应;现象:浮、熔、游、红、嘶2Na+2H2O=2NaOH+H2↑与酸反应;现象与水反应相似,更剧烈,钠先与酸反应,再与水反应。与盐溶液反应;钠先与水反应,生成NaOH,H2,再考虑NaOH与溶液中的盐反应。如:钠投入CuSO4溶液中,有气体放出和蓝色沉淀。2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑与某些熔融盐:4Na+TiCl4========4NaCl+Ti(冶炼稀有金属)4、保存煤油或石蜡中,使之隔绝空气和水5、制取2NaCl(熔融)====2Na+Cl2↑700~800oC通电
二、碳酸钠与碳酸氢钠的性质比较碳酸钠(Na2CO3)碳酸氢钠(NaHCO3)俗名纯碱、苏打小苏打溶解性易溶(同温下,溶解度大于碳酸氢钠)易溶热稳定性稳定2NaHCO3△Na2CO3+CO2↑+H2O与酸盐酸Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑碳酸Na2CO3+H2O+CO2=2NaHCO3不能反应与碱NaOH不能反应NaHCO3+NaOH=Na2CO3+H2OCa(OH)2Na2CO3+Ca(OH)2=CaCO3+2NaOH产物与反应物的量有关
三、镁的性质物理性质银白色金属,密度小,熔沸点较低,硬度较小,良好的导电导热性化学性质与O22Mg+O2====2MgO与其他非金属Mg+Cl2====MgCl2,3Mg+N2====Mg3N2与氧化物2Mg+CO2====2MgO+C与酸Mg+2HCl=MgCl2+H2↑制取MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2Mg(OH)2+2HCl=MgCl2+2H2OMgCl2•6H2O====MgCl2+6H2O↑MgCl2(熔融)=====Mg+Cl2↑点燃点燃点燃点燃通电
四、侯氏制碱法向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO2,利用NaHCO3溶解度较小,析出NaHCO3,将析出的NaHCO3晶体煅烧,即得Na2CO3。NaCl+CO2+NH3+H2O==NH4Cl+NaHCO32NaHCO3△Na2CO3+CO2↑+H2O
五、电解质和非电解质电解质非电解质定义溶于水或熔化状态下能导电的化合物溶于水和熔化状态下都不能导电的化合物物质种类大多数酸、碱、盐,部分氧化物大多数有机化合物,CO2、SO2、NH3等能否电离能不能实例H2SO4、NaOH、NaCl、HCl等酒精,蔗糖,CO2,SO3等
实验室制取气体知识框架(1)反应原理 (2)装置(包括发生装置和收集装置)(3)除杂 (4)收集方法(5)检验 (6)尾气处理学习物质的物理性质一般从如下几方面研究(1)色(颜色) (2)味(气味) (3)态(状态)(4)度(密度、硬度、溶解度) (5)点(熔点、沸点)(6)性(刺激性、挥发性、毒性、特性)氯气与金属的反应规律(1)氯气与金属反应时,生成高价态的化合物。(2)氯气与大多数金属在点燃或灼烧情况下反应,生成金属氯化物。(3)铁与氯气等氧化性强的非金属反应生成Fe3+的化合物,而与弱氧化性的非金属(I2、S等)生成Fe2+的化合物。
氧化还原反应规律(1)氧化剂——得电子——化合价降低——被还原——还原反应——还原产物;还原剂——失电子——化合价升高——被氧化——氧化反应——氧化产物。(2)氧化还原反应中得失电子守恒规律,化合价升降总数相等。(3)价态表现规律(4)氧化还原反应性质转递规律氧化性:氧化剂>氧化产物还原性:还原剂>还原产物
金属钠与盐酸或稀硫酸反应的两种情况①若酸过量则只考虑钠与酸即H+的反应;②若钠过量则过量的钠还要与水反应。钠与盐溶液的反应钠与盐溶液反应时,不能置换出盐中的金属,因为金属阳离子在水中一般都是以水合离子形式存在的,金属阳离子不能直接接触钠。所以钠与盐溶液反应时,首先是钠与水反应生成氢氧化钠和氢气,若氢氧化钠和与盐中的金属阳离子能生成难溶性碱,则氢氧化钠和盐溶液继续反应,否则钠只和水反应。如Na与FeCl3溶液的反应为:6Na+2FeCl3+6H2O==2Fe(OH)3↓+6NaCl+H2↑
离子在溶液中能否大量共存问题离子在溶液中能否大量共存的关键就是看离子间是否符合离子反应发生的条件,若反应则不能大量共存。1.看离子间能否发生复分解反应(1)离子间能否生成难溶物。需熟练记住常见物质的溶解性表。如BaSO4是难溶于水的,故Ba2+与SO42-在溶液中不能大量共存,与能形成微溶物的离子也不能大量共存。如Ca2+与OH-(2)离子间能否反应生成挥发性的物质(气体)。H+分别与HCO3-、CO32-、SO32-等在水溶液中因生成气体而不能大量共存。(3)离子间能否反应生成难电离的物质(弱酸、弱碱或水等)。如H++ClO-==HClO,OH-+NH4+==NH3·H2O,H++OH-==H2O,所以H+与ClO-、H+与OH-、OH-与NH4+在溶液中不能大量共存。
2.看离子间能否发生氧化还原反应而大量共存。如Fe2+、S2-、S032-等有较强的还原性一般不能与MnO4-、HNO3、H2O2、Cl2、HClO等强氧化剂共存。镁可以在一些气态非金属氧化物中燃烧如:2Mg+SO2==2MgO+S2Mg+CO2==2MgO+C
六、离子方程式的书写方法:写——写出反应的化学方程式;拆——把易溶于水,易电离的物质拆成离子形式删——将不参加反应的离子从方程式两端删去。查——检查方程式两端各元素的原子个数和电荷数是否相等。
离子方程式的书写原则1.强酸、强碱和易溶性的盐改写成离子形式,难溶物、难电离的物质(如弱酸、弱碱和水等)、易挥发性的物质、单质、氧化物、非电解质等均不能写成离子形式,要写化学式。2.微溶物是生成物时,一律视为沉淀,写化学式,标↓符号;如是反应物,若是澄清溶液就写离子,若是悬浊液就写化学式。3.多元弱酸的酸式根离子不能拆开,如HCO3-不能拆成H+和CO32-。4.强电解质参加的离子反应,如果反应时没有达到电离条件,即没有电离,(反应物是固体时)则也不能改写成离子方程式。如实验室用高锰酸钾加热分解制氧气就不能写。
离子方程式书写正误判断1.看是否符合客观事实。如Fe跟H2SO4反应,写成2Fe+6H+==2Fe3++3H2↑是错误的。2.看是否漏掉离子。如H2SO4与Ba(OH)2溶液的反应,写成Ba2++SO42-==BaSO4↓+H2O或H++OH-==H2O都是错误的。3.看是否可拆成离子。如CaCO3与稀HCI反应写成2H++CO32-==CO2↑+H2O是错误的。4.是否遵循质量守恒和电荷守恒。如Cu+Ag+==Cu2++Ag,Na+H2O==Na++OH-+H2↑都是错误的。'
您可能关注的文档
- 最新中考物理复习课件力和简单机械课件PPT.ppt
- 最新中考物理复习指导课件苏教版电流电压课件PPT.ppt
- 最新中考物理机械能1课件PPT.ppt
- 最新中考物理总复习第二部分专题训练专题二实验专题内文部分课件课件PPT.ppt
- 最新中考物理总复习第十八章机械能及其转化、机械效率课件课件PPT.ppt
- 最新中考物理总复习电学实验专题(ppt课件课件PPT.ppt
- 最新中考物理总复习大气压强、流体压强课件课件PPT.ppt
- 最新中考物理总复习专题三图片、图像信息题习题课件新人教版课件PPT.ppt
- 最新中考生物实验考试及注意事项课件PPT.ppt
- 感恩母亲节课件PPT.ppt
- 最新中考物理综合复习学案课件电功率课件PPT.ppt
- 最新中考科学精品课件专题29-物质的变化和化学反应类型课件PPT.ppt
- 最新中考英语专题复习课件-形容词副词课件PPT.ppt
- 最新中考英语反义疑问句复习课件PPT课件.ppt
- 最新中考英语单项选择答题技巧课件PPT.ppt
- 最新中考英语复习之动词-课件课件PPT.ppt
- 最新中考英语知识点总复习之名词共40张PPT课件PPT.ppt
- 最新中考英语总复习精讲课件专题十二-复合句课件PPT.ppt