- 1.74 MB
- 2022-04-29 14:33:03 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'配位化合物与配位滴定
1.掌握配位化合物的定义、组成、命名和分类2.掌握配位化合物价健理论,简要了解晶体场理论的基本要点3.掌握配位平衡和配位平衡常数的意义及其有关计算,理解配位平衡的移动及与其他平衡的关系4.了解螯合物形成的条件和特殊稳定性5.理解配位滴定的基本原理,配位滴定所允许的最低pH值和酸效应曲线,金属指示剂6.掌握配位滴定的应用学习要求
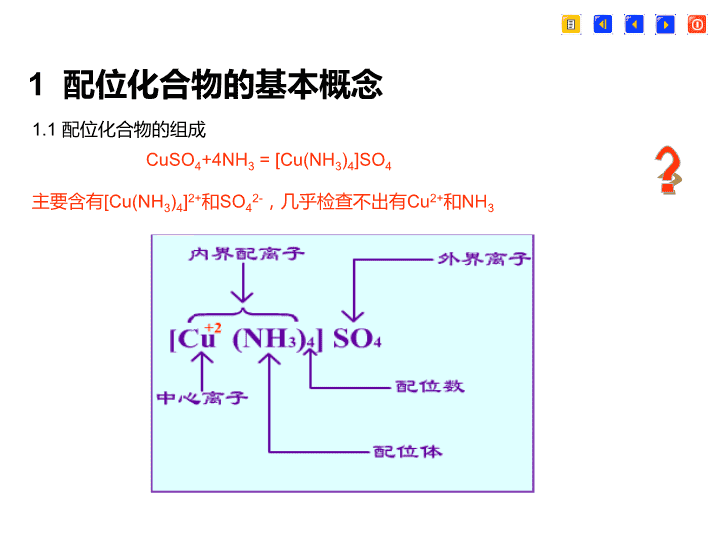
1配位化合物的基本概念1.1配位化合物的组成CuSO4+4NH3=[Cu(NH3)4]SO4主要含有[Cu(NH3)4]2+和SO42-,几乎检查不出有Cu2+和NH3?
1.配位阴离子配合物K2[SiF6]六氟合硅(Ⅳ)酸钾Na[Co(CO)4]四羰基合钴(Ⅲ)酸钠2.配位阳离子配合物[Co(NH3)6]Br3三溴化六氨合钻(Ⅲ)[Co(NH3)2(en)2](NO3)3硝酸二氨·二(乙二胺)合钴(Ⅲ)3.中性配合物[PtCI2(NH3)2]二氯·二氨合铂(Ⅱ)[Ni(CO)4]四羰基合镍一ONO亚硝酸根一NO2硝基一SCN硫氰酸根一NCS异硫氰酸根
2配位化合物的化学健理论2.1配位化合物的价健理论美国鲍林价键理论的主要内容是:1.配合物的中心离子M同配位体L之间以配位键结合,表示为M←L配位体,配位原子提供孤对电子,中心离子提供空轨道。2.中心离子用能量相近的轨道杂化,以杂化的空轨道形成配位键。配位离子的空间结构、配位数、稳定性等,主要决定于杂化轨道的数目和类型。
配位数杂化轨道类型空间构形配离子类型实例2sp直线型外轨型Ag(CN)2-3sp2平面三角型外轨型HgI3-,4sp3正四面体型外轨型Zn(NH3)42+4dsp2平面正方型内轨型PtCl42-6sp3d2正八面体外轨型Fe(H2O)626d2sp3正八面体内轨型Fe(CN)64-配合物的杂化轨道和空间构型
3.根据轨道参加杂化的情况,配合物可分为外轨型和内轨型。a配位原子电负性较小,如C(在CN-,CO中),N(在NO2-中)等,形成内轨型配合物。键能大,稳定。b配位原子的电负性较大,如卤素、氧等,形成外轨型配合物。键能小,不稳定。
可通过对配合物磁矩的测定来确定内、外轨型m为磁矩,SI单位为A·m2;n为分子中未成对电子数;μB为玻尔磁子,是衡量磁矩值的物理常量,μB=9.274078×10-24A·m2。表磁矩的理论值与未成对电子数的关系未成对电子数m/μB未成对电子数m/μB0033.8711.7344.9022.8355.92
例用价健理论说明Zn(CN)42-离子的空间构型及其磁矩大小.外轨型配合物磁矩不变;内轨型配合物磁矩变小。如果配合物分子中配位体没有未成对电子,则其磁矩为零。
2.2晶体场理论简介1.晶体场理论的主要内容1928年,皮塞中心离子处于带负电荷的配位体(阴离子或极性分子)所形成的晶体场时,中心离子与配位体之间的结合是完全靠静电作用,不形成共价健。中心离子的d轨道在配位体静电场的影响下会发生分裂,即原来能量相同的5个d轨道会分裂成两组或两组以上的能量不同的轨道。分裂的情况主要决定于中心离子和配位体的本质,以及配位体的空间分布。根据d轨道分dxy,dyz,dxz,dx2-y2,dz2等5种。当配位体所形成的晶体场作用于这个离子时,d轨道发生能级分裂现以配位数为6,空间构形为八面体的配合物为例说明。
八面体场中的d轨道
d轨道在正八面体场内的能级分裂
晶体场分裂能分裂后最高能级eg和最低能级t2g之间的能量差,用Δo或10Dq表示。相当于一个电子由t2g轨道跃迁到eg轨道所需要的能量。1.不同的配位体大致按下列顺序影响Δo值:I-Δo,形成高自旋形,很强的磁性;当Δo>P时,形成低自旋型,很弱的磁性。[FeF6]3-F-弱场配体,高自旋,强磁性[Fe(CN)6]3-CN-强场配体,低自旋,磁性弱配合物的颜色含d1到d9水合离子的颜色分别为:d1d2d3d4d5Ti(H2O)63+V(H2O)63+Cr(H2O)63+Cr(H2O)62+Mn(H2O)62+紫红绿紫天蓝肉红d6d7d8d9Fe(H2O)62+Co(H2O)62+Ni(H2O)62+Cu(H2O)42+淡绿粉红绿蓝
3配离子在溶液中的解离平衡[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2ONaOHCu(OH)2无Cu2+???NaS有黑色CuS生成有Cu2+
3.1配位平衡常数1.稳定常数Kf为配合物的稳定常数,Kf值越大,配离子越稳定。2.不稳定常数[Cu(NH3)4]2+Cu2++4NH3Kd为配合物的不稳定常数或解离常数。Kd值越大表示配离子越容易解离,即越不稳定。
3.逐级稳定常数金属离子M能与配位剂L形成MLn型配合物,这种配合物是逐步形成的,这类稳定常数称为逐级稳定常数Kf,,nM+LML,第一级逐级稳定常数为:ML+LML2,第二级逐级稳定常数为:MLn-1+LMLn,第n级逐级稳定常数为:
4.累积稳定常数(βn)最后一级累积稳定常数就是配合物的总的稳定常数
例比较0.10mol·L-1[Ag(NH3)2]+溶液和含有0.2mol·L-1NH3的0.10mol·L-1[Ag(NH3)2]+溶液中Ag+的浓度。解:设0.10mol·L-1[Ag(NH3)2]+溶液中Ag+的浓度为xmol·L-1。根据配位平衡,有如下关系Ag++2NH3[Ag(NH3)2]2+起始浓度/mol·L-!000.1平衡浓度/mo1·L-1x2x0.1-x由于c(Ag+)较小,所以(0.1-x)mol·L-!≈0.1mol·L-!,将平衡浓度代入稳定常数表达式得:
设在0.2mol·L-1NH3存在下,Ag+的浓度为ymol·L-1,则:Ag++2NH3[Ag(NH3)2]2+起始浓度/mol·L-!00.20.1平衡浓度/mo1.·L-1y0.2+2y0.1-y由于c(Ag+)较小,所以(0.1-y)mol·L-!≈0.1mol·L-!,0.2+2y≈0.2mol·L-!,将平衡浓度代入稳定常数表达式:
3.2配位平衡的移动Mn++xL-MLx(n-x)水解酸效应沉淀氧化还原1.酸度的影响2.沉淀影响3.氧化还原的影响
1.酸度的影响Fe3++6F-[FeF6]3-+6H+6HF总反应为:[FeF6]3-+6H+Fe3++6HFKf越小,即生成的配合物稳定性越小;Ka越小,即生成的酸越弱,K就越大。
Fe3++6F-[FeF6]3-+3OH-Fe(OH)3↓2.沉淀反应对配位平衡的影响[Cu(NH3)4]2+Cu2++4NH3+S2-CuS↓总反应为:[Cu(NH3)4]2++S2-CuS↓+4NH3既要考虑配位体的酸效应,又要考虑金属离子的水解效应。
可知Kf越小,Ksp越小,则生成沉淀的趋势越大,反之则生成沉淀的趋势越小。例0.2mol·L-1AgNO3溶液lmL中,加入0.2mol·L-1的KCI溶液lmL,产生AgCl沉淀。加入足够的氨水可使沉淀溶解,问氨水的最初浓度应该是多少?
解:假定AgCl溶解全部转化为[Ag(NH3)2]+,若忽略[Ag(NH3)2]+的离解,则平衡时[Ag(NH3)2]+的浓度为0.1mol·L-,C1-的浓度为0·1mol.L-。反应为:AgCl+2NH3[Ag(NH3)2]++Cl-在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L-1,所以氨水的最初浓度为2.22+0.2=2.42mol·L-1
3.氧化还原反应与配位平衡[Fe(SCN)6]3-6SCN-+Fe3++Sn2+Fe2++Sn4+总反应为2[Fe(SCN)6]3-+Sn2+2Fe2++12SCN-+Sn4+Fe3++eFe2+φ(Fe3+/Fe2+)=0.771VI2+2e2I-φ(I2/I-)=0.536VFe3+可以把I-氧化为I2,其反应为Fe3++I-Fe2++1/2I2加入F-,Fe3+立即与F-形成了[FeF6]3-,总反应:Fe2++1/2I2+6F-[FeF6]3-+I-
例计算[Ag(NH3)2]++eAg+2NH3的标准电极电势。解:查表得Kf{Ag(NH3)2+}=1.12107,(Ag+/Ag)=0.799V(1)求配位平衡时c(Ag+)Ag++2NH3[Ag(NH3)2]+此时c([Ag(NH3)2]+)=c(NH3)=1mol·L-1,所以
②求φ{Ag(NH3)+/Ag}φ(Ag+/Ag)=φ(Ag+/Ag)+0.059/nlgc(Ag+)=0.799+0.059lg9210-8=0.382V根据标准电极电势的定义,c([Ag(NH3)2]+)=c(NH3)=1mol·L-1时,φ(Ag+/Ag)就是电极反应[Ae(NH3)2]++eAg+2NH3的标准电极电势。即φ{Ag(NH3)+/Ag}=0.382V
思考题:在反应2Fe3++2I-2Fe2++I2中,若加入CN-,问新的反应2[Fe(CN)6]3-+2I-2[Fe(CN)6]4-+I2能否进行?
4螯合物中心离子与多基配位体键合而成,并具有环状结构的配合物称为螯合物4.1螯合物的形成NH2—CH2—CH2—NH2简写为en二(乙二胺)合铜(Ⅱ)离子五六元环张力最小
4.2螯合效应由于整环的形成而使螯合物具有的特殊的稳定性称为螯合效应[Ni(H2O)6]2++6NH3[Ni(NH3)6]2++6H2O[Ni(H2O)6]2++3en[Ni(en)3]2++6H2OKf分别为9.1107和3.91018G=-RTlnKfG=H-TS所以lnKf=S/R-H/RTKf的大小决定于S和H,H决定于反应前后键能的变化,相差不大。螯合物之所以比一般配合物稳定,就是由于螯合反应熵值增加之故。
若干离子的热力学数据配离子HkJmol-1GkJmol-1TSkJmol-1lg[M(NH3)2]2+或lg[M(en)]2+[Zn(NH3)2]2+-21-270.425.01[Zn(en)]2+-27.7-35.27.546.15Cd(NH3)2]2+-29.8-23-1.554.97Cd(en)]2+-29.5-33.43.95.84Cu(NH3)2]2+-50.3-44.8-5.457.87Cu(en)]2+-61.2-62.81.6811.02
5配位滴定法5.1配位滴定法的特点EDTA是一个四元酸,通常用H4Y表示.常见的还有氨三乙酸(NTA)、环己烷二胺四乙酸(CyDTA)和乙二醇二乙醚二胺四乙酸(EGTA)等。用于配位滴定的反应必须符合完全、定量、快速和有适当指示剂来指示终点等要求。常用氨羧配位剂
5.2乙二胺四乙酸在溶液中的解离平衡H2Y2-H++HY3-H6Y2+H++H5Y+H5Y+H++H4YH4YH++H3Y-H3Y-H++H2Y2-
HY3-H++Y4-EDTA各种型式的分布系数与溶液pH的关系在pH12的溶液中,主要以Y4-型存在
5.3乙二胺四乙酸与金属离子的配位平衡EDTA–Ca螯合物的立体结构M+YMYEDTA分子中具有六个配位原子,EDTA:中心离子=1:1EDTA与无色金属离子形成的配合物也是无色的;而与有色金属离子形成配合物的颜色一般加深。例如,Cu2+显浅蓝色,而CuY2-为蓝色,Ni显浅绿色,而NiY2-为蓝绿色,
5.4乙二胺四乙酸配合物的条件平衡常数主反应M+YMYOH-↙↘LH+↙↘NH+↙↘OH-副反应M(OH)MLHYNYMHYMOHY:::M(OH)nMLnH6Y产物MY发生副反应对滴定反应是有利的,金属离子M和配位剂Y的副反应都不利于滴定反应。
1.酸效应酸度升高,酸效应系数αY(H)增大,与金属离子配位能力越小。酸效应系数αY(H)是指未参加配位反应的EDTA各种存在形体的总浓度c(Y’)与能直接参与主反应的Y4-的平衡浓度c(Y4-)之比
EDTA在不同pH条件时的酸效应系数pHlgαY(H)pHgαY(H)pHlgαY(H)pHlgαY(H)0.00.40.81.01.41.82.02.42.83.03.423.6421.3219.0810116.0214.2713.5112.1911.0910.609.703.84.04.44.85.05.45.86.06.46.87.085447.646.846.455.694.984.654.063.553.327.47.80489.09.49.810.010.410.82.882.472.271.871.481.280.920.590.450.240.1111.011.511.611.711.811.912.012.112.213.013.90.070.020.020.020.010.010.010.010.0050.00080.0001
2.配位效应配位效应系数αM(L)它是指未与滴定剂Y4-配位的金属离子M的各种存在形体的总浓度c(M’)与游离金属离子浓度c(M)之比
总αM=αM(L)+αM(OH)
例计算pH=11.0,c(NH3)=0.10mol.L-时的αM值。解:αZn(NH3)+=1+c(NH3)β1+c2(NH3)β2+c3(NH3)β3+c4(NH3)β4=1+102.37-1.0+104.81-2.0+107.31-3.0+109.46-4.0=1+101.37+102.81+104.31+105.46=105.49根据附录,pH=11时,αZn(oH)=105.4所以αM=αM(L)+αM(OH)=105.49+105.4≈105.7
3.配合物的条件平衡常数lgKf’=lgKf–lgαM(L)–lgαY(H)副反应系数越大,Kf’越小。这说明了酸效应和配位效应越大,配合物的实际稳定性越小。
例计算在pH=2和pH=5时,ZnY的条件稳定常数解:已知lgKf(ZnY)=16.5查表可知pH=2.0时,lgαY(H)=13.8,lgαZn(OH)=0所以lgKf’(ZnY)=lgKf(ZnY)–lgαY(H)–lgαZn(OH)=16.5–13.8–0=2.7Kf’(ZnY)=102.7pH=5.0时,lgαY(H)=6.6,lgαZn(OH)=0所以lgKf’(ZnY)=lgKf(ZnY)–lgαY(H)–lgαZn(OH)=16.5–6.6–0=9Kf’(ZnY)=109
6配位滴定曲线6.1配位滴定曲线例EDTA溶液滴定Ca溶液,已知c(Ca2+)=0.01000mol·L-1,V(Ca2+)=20.00mL,c(Y)=0.01000mol·L-1,pH=10,体系中不存在其它的配位剂。已知lgKf(CaY)=10.7,lgαY(H)=0.45解lgKf’(CaY)=lgKf(CaY)–lgαY(H)=10.7–0.45=10.25即Kf’(CaY)=1.810101.滴定前c(Ca2+)=0.01000mol·L-1,pCa=2.02.滴定开始至化学计量点前加入乙二胺四乙酸标准溶液100mL时
pCa=3.3加入乙二胺四乙酸标准溶液19.98mL时pCa=5.33.化学计量点时由于CaY配合物比较稳定,所以在化学计量点时
化学计量点时c(Ca2+)=c(Y’),所以,4.化学计量点后当加入的滴定剂为22.02mL时
同时,可近似认为c(CaY’)=5.0×10-3mol·L-1
EDTA滴定Ca2+的滴定曲线金属离子浓度对滴定曲线的影响
lgKf’对滴定曲线的影响1.pH值越大,滴定突跃越大,pH值越小,滴定突跃越小。2.MY配合物的条件稳定常数越大;突跃范围也越大。要想滴定误差≤0.1%则必须c(M)·Kf’(MY)≥106。当金属离子浓度c(M)=0.01mol·L-1时,lgKf’(MY)≥8
6.2配位滴定所允许的最低pH值和酸效应曲线若金属离子没发生副反应lgKf’=lgKf-lgαY(H)lgKf’(MY)≥8lgKf-lgαY(H)≥8lgαY(H)≤lgKf-8查表得相应的pH值,即为滴定某一金属离子所允许的最低pH值如:lgKf(MgY)=64,lgαY(H)≤64-8=0.64,最低pH值为9.7lgKf(CaY)=11.0,lgαY(H)≤11.0-8=3,最低pH值为7.3lgKf(FeY)=24.23,lgαY(H)≤24.23-8=16.23,最低pH值为1.3。
可以找出单独滴定某一金属离子所需的最低pH值。可以看出在一定pH值时,哪些离子被滴定,哪些离子有干扰.从而可以利用控制酸度,达到分别滴定或连续滴定的目的。EDTA的酸效应曲线
7金属指示剂7.1金属指示剂的变色原理M+InMIn金属离子(甲色)(乙色)MIn+YMY+In(乙色)(甲色)
金属离子与指示剂稳定性应小于Y4-与金属离子所生成配合物的稳定性,一般Kf值要小二个数量级。显色反应要灵敏、迅速、有一定的选择性。此外,指示剂与金属离子配合物应易溶于水,指示剂比较稳定,便于贮藏和使用。终点颜色变化明显,便于眼睛观察。作为金属指示剂应该具备以下条件:
7.2常用的金属指示剂1.铬黑T(EBT)铬黑T是弱酸性偶氮染料,其化学名称是1-(1-羟基-2萘偶氮)-6硝基-2-萘酚-4-磺酸钠-H+-H+H2In-HIn2-In3-+H++H+(红色)(蓝色)(橙色)pH<6pH~11pH>12在pH值为7~11的溶液里指示剂显蓝色,与红色有极明显的色差,pH值在9~10.5之间最合适。
铬黑T可作Zn2+、Cd2+、Mg2+、Hg2+等离子的指示剂例:Mg2++HIn2-MgIn-+H+(蓝色)(红色)Mg2++HY3-MgY2-+H+MgIn-+HY3-MgY2-+HIn2-(红色)(蓝色)红色→紫色→蓝色
2.钙指示剂钙指示剂的化学名称是2-羟基-1-(2-羟基-4-磺酸基-1-萘偶氮)-3-萘甲酸,也称钙红。黑紫色粉末,此指示剂的水溶液在pH<8时为酒红色,在pH为0~13.7时为蓝色,而在pH为12~13之间与Ca2+形成酒红色的配合物,可用于Ca2+、Mg2+共存时作测Ca2+的指示剂(pH=12.5),
7.3使用指示剂中存在的问题1.指示剂的封闭现象某些金属离子与指示剂形成的配合物(MIn)比相应的金属离子与乙二胺四乙酸配合物(MY)更稳定,在滴定其他金属离子时,若溶液中存在这些金属离子,则溶液一直呈现这些金属离子与指示剂形成的配合物MIn的颜色,即使到了化学计量点点也不变色,这种现象称为指示剂的封闭现象(blocking)。例如在pH=10时以铬黑T为指示剂滴定Ca2+,Mg2+总量时,Al3+、Fe3+、Cu2+、Co2+、Ni2+会封闭铬黑T.使终点无法确定。这时就必须将它们分离或加入掩蔽剂以消除干扰。
2.指示剂的僵化现象有些指示剂本身或金属离子与指示剂形成的配合物在水中的溶解度太小,使滴定剂与金属--指示剂的配合物交换缓慢,终点拖长,这种现象称为指示剂的僵化。解决办法是加入有机溶剂或加热以增大其溶解度,从而加快反应速度,使终点变色明显。
3.指示剂的氧化变质现象金属指示剂大多为含有双键的有色化合物,易被日光,氧化剂,空气所分解,在水溶液中多不稳定,日久会变质。如铬黑T在Mn(Ⅳ)、Ce(Ⅳ)存在下,会很快被分解褪色。为了克服这—缺点,常配成固体混合物,加入还原性物质如抗坏血酸、羟胺等,或临用时才配制。
8配位滴定的应用1滴定方式1.直接滴定当金属离子与乙二胺四乙酸的反应满足滴定要求时就可以直接进行滴定。这种方法是将分析溶液调节至所需酸度,加入其他必要的辅助试剂及指示剂,直接用乙二胺四乙酸进行滴定,然后根据消耗标准溶液的体帜,计算试样中被测组分的含量。这是配位滴定中最基本的方法。
2.返滴定当被测离子与乙二胺四乙酸反应缓慢,被测离子在滴定的pH值下会发生水解;被测离子对指示剂有封闭作用,又找不到合适的指示剂时;无法直接滴定,而应改用返滴定法。例如,用乙二胺四乙酸滴定Al3+时,由于A13+与Y4-配位缓慢;在酸度较低时,Al3+发生水解,使之与乙二胺四乙酸配位更慢,A13+又封闭指示剂,因此不能用直接法滴定。
3.置换摘定法以金属离子N的配合物作试剂,与被分析离子M发生置换反应。置换出的金属离子N用乙二胺四乙酸滴定。间接滴定法有些金属离子与Y4-形成的配合物不稳定,而非金属离子则不与Y4-形成配合物。若被测离子能定量地沉淀为有固定组成的沉淀,而沉淀中另一种金属离子能用乙二胺四乙酸滴定,这样可通过滴定后者来间接求得检测离子的含量。
2提高配位滴定选择性的方法1.控制酸度溶液的酸度对乙二胺四乙酸配合物的稳定性有很大影响。故在某些情况下,适当控制酸度常常可以提高滴定的选择性。2.掩蔽法加入一种试剂,使干扰离子生成更为稳定的配合物,或发生氧化还原反应以改变干扰离子的价态,或生成微溶沉淀以消除干扰,这些方法称为掩蔽法。加入的试剂称为掩蔽剂,按反应类型不同,可分为:配位掩蔽法氧化还原掩蔽法沉淀掩蔽法
3.解蔽法所谓解蔽是指被掩蔽物质从其掩蔽形式中释放出来,恢复其参与某一反应的能力。如Zn2+、Mg2+共存时,可在pH=10的缓冲溶液中加入氰化钾,使Zn2+形成[Zn(CN)4]2-配离子而被掩蔽。先用乙二胺四乙酸单独滴定Mg2+。然后在滴定过Mg2+的溶液中加入甲醛溶液,以破坏[Zn(CN)4]2-配离子,使Zn2+释放出来而解蔽,反应中释放出来的Zn2+,可用乙二胺四乙酸继续滴定。
3配位滴定的应用1.乙二胺四乙酸标准溶液的配制和标定常用的乙二胺四乙酸标准溶液浓度为0.01~0.05mol·L-1。乙二胺四乙酸标准溶液常采用间接法配制。先配成近似所需的浓度,再用基准物质金属锌、ZnO、CaCO3或MgSO4·7H2O等来标定它的浓度。
2.水中钙镁的测定乙二胺四乙酸测定水中钙、镁常用的方法是先测定钙、镁总量,再测定钙量,然后由钙、镁总量和钙的含量,求出镁的含量。钙、镁总量的测定取一定定体积水样,调节pH=10,加铬黑T指示剂,然后用乙二胺四乙酸滴定。铬黑T和Y4-分别都能和Ca2+、Mg2+生成配合物。它们的稳定性顺序为CaY2->MgY2->MgIn->CaIn-被测试液中先加入少量铬黑T,它首先与Mg2+结合生成酒红色的MgIn-配合物。滴入乙二胺四乙酸时,先与游离Ca2+配位,其次与游离Mg2+配位.最后夺取MgIn-中的Mg2+而游离出EBT,溶液由红经紫到蓝色,指示终点的到达。
钙的测定取同样体积的水样,用NaOH溶液调节到pH=12,此时M2+以Mg(OH)2沉淀析出,不干扰Ca2+的测定。再加入钙指示剂,此时溶液呈红色。再滴入乙二胺四乙酸,它先与游离Ca2+配位,在化学计量点时夺取与指示剂配位的Ca2+,游离出指示剂,溶液转变为蓝色,指示终点的到达。从消耗标准溶液的体积和浓度计算Ca的量。
Thankyou!78
'
您可能关注的文档
- 最新部编版二下-第3课-《开满鲜花的小路》ppt课件课件PPT.ppt
- 最新部编版二年级下册语文园地三课件PPT.ppt
- 最新部编版二年级上册语文植物妈妈有办法完整版(1)课件PPT.ppt
- 最新部编版二年级上册识字4田家四季歌课件PPT.ppt
- 最新部编版小壁虎借尾巴-公开课ppt课件PPT.ppt
- 最新部编语文《相见欢》课件课件PPT.ppt
- 最新部首查字法微课PPT课件PPT.ppt
- 最新鄂教小学语文三上《13守信》[余运香]【市级】优质课课件PPT课件.ppt
- 最新鄂六上语文乐园四课件PPT.ppt
- 最新鄂教版小学科学四年级下册《13玩气球》课件PPT课件.ppt
- 最新配电系统中谐波电压、电流含量用EXCEL表格快速估算课件PPT.ppt
- 最新配方法的步骤:1、化12、移项3、配方4、求解配方的关键是【共享精品-】课件PPT.ppt
- 最新配方大全-非常普遍的9款中式酱料配方及制作方法课件PPT.ppt
- 最新酒店从业人员的礼貌礼仪课件PPT.ppt
- 最新酒店服务意识(饭店)课件PPT.ppt
- 最新酶学-08酶的应用课件PPT.ppt
- 最新酵母菌发酵培养基优化要点课件PPT.ppt
- 最新酸性水经过氢氧型离子交换树脂时课件PPT.ppt