- 1.66 MB
- 2022-04-29 14:28:03 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'烯烃--分子中有一个碳碳双键的开链不饱和烃.烯烃的通式--CnH2n烯烃>C=C<是烯烃的官能团.
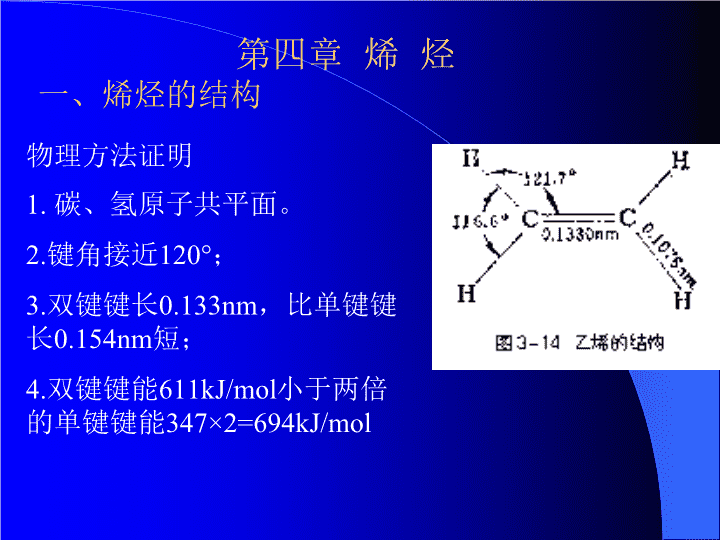
第四章烯烃一、烯烃的结构物理方法证明1.碳、氢原子共平面。2.键角接近120°;3.双键键长0.133nm,比单键键长0.154nm短;4.双键键能611kJ/mol小于两倍的单键键能347×2=694kJ/mol
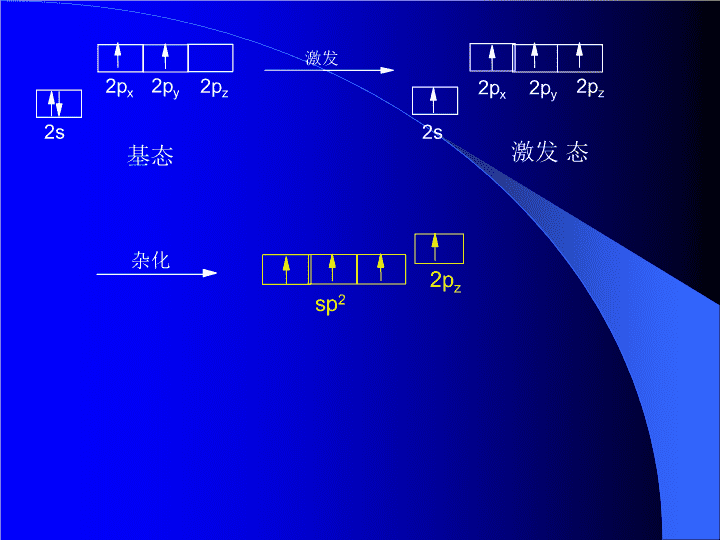
2s2px2py2pz基态2px激发激发态2s2py2pz杂化
④剩余的未参与杂化的p轨道,垂直于三个sp2杂化轨道所在的平面。sp2的特点①sp2杂化轨道的形状与sp3类似,呈葫芦型②能量介于s和p轨道之间;③方向性:三个sp2杂化轨道以C原子为中心,分别指向正三角形的三个顶点。5)电负性:sp2>sp3
乙烯的形成
象这种以“肩并肩”的形式在侧面相互交盖而形成键,叫做π键。π键的成键电子称为π电子。π键的特点:①π键的电子云分布在平面的上下方;②π键不能作相对旋转,③π键键能较小,易断裂;④π电子云易流动,易极化。
1-丁烯2-甲基丙烯(异丁烯)2-丁烯二、烯烃的同分异构和命名1.构造异构体的命名
烯基:丙烯基烯丙基异丙烯基乙烯基
系统命名法:(1)选主链:选择含有不饱和键的最长碳链作主链;5-甲基-2-己烯(2)编号:不饱和键的位次最小,取代基的位次尽可能小(3)命名:烯前要冠以官能团位置的数字(编号最小);其它同烷烃的命名规则.
4-甲基-3-乙基己烯如双键位置在第一个碳上,双键位置数据可省.
例:3-甲基-6-乙基-4-辛烯6-甲基-3-乙基-3-辛烯
例:3-乙烯基-1,3,5-辛三烯取代基
顺式反式2.顺反异构体的命名由于双键碳不能相对旋转,若双键碳原子上各自连有两个不同的基团时,则有顺反异构bp:3.5C0.9C顺反异构体,因几何形状(结构)不同,物理性质不同。
无顺反异构条件:1)分子中有限制旋转的因素(如:双键、环等);2)碳原子上连有两个不同的基团。
顺反法和Z/E法两种命名方法。顺反命名法:两个相同基团在双键的同侧,叫顺式,反之叫反式。如:顺-2-丁烯反-2-丁烯顺-3-甲基-2-戊烯
如果两个优先基团处于双键的同侧,称为“Z”式结构,处于异侧的称为“E”式结构。(Z)-3-甲基-2-戊烯(E)-3-甲基-4-乙基-3-庚烯Z/E命名法:
(E)-3-甲基-4-乙基-1,3,5-己三烯(Z)-3-甲基-2-戊烯反-3-甲基-4-乙基-1,3,5-己三烯反-3-甲基-2-戊烯
并不是所有“顺式”的结构都是“Z式”的;同样“反式”的结构也不都是“E式”的。顺-2-氯-2-丁烯(E)-2-氯-2-丁烯顺/反命名法和Z/E命名法无必然的联系。注:
思考?为什么顺式烯烃的沸点高于反式烯烃的沸点,而其熔点又低于反式烯烃的熔点?三、烯烃的物理性质(自学)总结烯烃的状态、熔沸点等变化规律。
四烯烃的化学性质1、π键的键能较小,π电子云易流动,易极化,易于断裂,易发生加成反应。2、氧化反应3、活泼α-氢的反应α-碳sp3杂化α-氢sp2杂化
1、催化加氢催化剂反应历程:在催化剂表面吸附-脱附过程
1)常用的催化剂:Ni,Pt,Pd,Rh等金属。工业上常采用雷尼镍注:2)催化加氢是放热反应。一摩尔烯烃催化加氢放出的热量叫做氢化热。烯烃的氢化热愈高,说明原化合物所含能量愈大,愈不稳定。利用氢化热的测定,可以比较不同烯烃的相对稳定性。
氢化热△H/kJ·mol-1137126127120115112表5-2一些烯烃的氢化热乙烯丙烯1-丁烯构 造 式名 称反-2-丁烯2,3-二甲基-2-丁烯顺-2-丁烯
双键碳上所连的烷基数愈多,烯烃愈趋稳定,各取代烯烃的相对稳定性次序为:R2C=CR2>R2C=CHR>R2C=CH2~RCH=CHR>RCH=CH2>CH2=CH2
3)双键碳上所连的取代基越多,催化加氢反应活性越低R2C=CR2HBr>HCl2)反应历程:HX=H++X-
3)烯烃的亲电加成反应活性烯烃的亲电加成反应活性:R2C=CR2>R2C=CHR>R2C=CH2~RCH=CHR>RCH=CH2>CH2=CH2sp3杂化sp2杂化象这种由于电负性不同的原子或原子团的影响,使分子内共用电子对向某一原子偏移,导致整个分子的成键电子云向着一个方向偏移,而使分子产生极化的电子效应,称为诱导效应;给电子诱导用“+”表示;吸电子用“-”表示。电子云密度增大
1-卤丙烷2-卤丙烷4)加成取向马氏规则:不对称烯烃与极性试剂加成时,试剂中带正电的部分,总是加到含氢较多的双键碳上,带负电部分则加到含氢较少的双键碳上。称为马尔科夫尼柯夫规律,简称马氏规则,也称不对称加成规则(主要产物)
马氏规则的理论解释:A.诱导效应sp3杂化sp2杂化当其它烷基与双键碳相连时,与甲基相似,也表现供电子性R→CH=CH2
B、反应中间体—正碳离子的稳定性正碳离子的稳定性为:
反应进程与活化能
5)有重排现象
1,2-甲基迁移。重排反应1,2-负氢迁移。1,2-负氢迁移
CH3CH3CH3CCH3>CH3-CHCH2--和杂化碳原子相连的甲基及其它烷基都有给电子性或供电性(与相连的氢原子比较).这是分子内各原子间静电的诱导作用而形成电子云偏移的结果,电子云偏移往往使共价键的极性也发生变化.这种因某一原子或基团的电负性(s>sp>sp2>sp3>p)而引起电子云沿着键链向某一方向移动的效应叫诱导效应.由于诱导效应,也由于超共轭效应,三个甲基都将电子云推向正碳原子,就减低了正碳原子的正电性,或者说,它的正电荷并不是集中在正碳原子上,而是分散到三个甲基上.+诱导效应诱导效应按照静电学,一个带电体系,电荷越分散,体系越稳定.稳定性比较+
(2)与H2SO4加成注:应用:①间接法合成符合马氏规则的醇;②硫酸氢烷基酯能溶于浓硫酸,可用于鉴别、分离提纯烯烃。加成产物符合马氏规则。H2O
水是一种弱酸,需在H+作催化剂的条件下才能进行。应用:直接法合成符合马氏规则的醇(3)与H2O的加成
注:1)不同卤素与烯烃的加成反应活性为:F2>Cl2>Br2>I2(4)与卤素加成
2)反应历程:卤素原子分别加到双键碳的两侧——反式加成。
应用:1)烯烃可使溴的CCl4溶液褪色,可用来鉴别烯烃2)用来合成邻二卤代烃。练习:分别写出顺-2-丁烯和反-2-丁烯与溴反应的产物,并说明产物是否有旋光性。外消旋体内消旋体,无旋光性。
(5)与HOX的加成注:①反应条件HOCl,HOBr,Cl2+H2O,Br2+H2O②反应历程与烯烃加溴反应类似,属于亲电加成,产物也为反式产物。HO—Xδ-δ+
1)反应分步进行:正碳离子的形成,正负离子的结合,决定反应速度的是正碳离子的形成。2)有副反应:副反应为正碳离子与体系中其他负离子结合。3)有重排现象4)符合马氏规则5)反式加成亲电加成反应小结:
3、自由基加成——过氧化效应或过氧化物hν主产物自由基型的加成反应。主产物注:烯烃的过氧化效应只是对HBr而言,HCl和HI均无此效应。
过氧化效应的机理烷氧基自由基稳定的3o自由基链引发链传递链终止:略……
4、硼氢化—氧化反应
①B2H6是BH3的二聚体。当B2H6与烯烃反应时,B2H6迅速离解为BH3。注:②反应历程四中心过渡态
特点:①加成产物为顺式产物;③生成反马氏规则的醇
②反应中无C+、C-的形成,所以无重排现象的发生;应用:合成反马氏规则的醇,尤其是伯醇。
1)高锰酸钾氧化顺式邻二醇5、氧化反应
应用:①根据氧化产物可以推测原烯烃的结构。②烯烃可以使高锰酸钾溶液褪色,可用于鉴别烯烃;例如:有一烯烃经酸性高锰酸钾氧化得到的产物为环己酮和乙酸,试推测原烯烃的结构。
2)臭氧氧化—还原反应臭氧化物
应用:根据氧化产物可以推测原烯烃的结构。例:有两烯烃经臭氧氧化—还原水解反应得到的产物分别为OHC(CH2)4COCH3;HCHO+(CH3)2CO,试推测原烯烃的结构。
3)催化氧化和环氧化反应:顺式加成
6、与卡宾加成卡宾:︰CH2是非常活泼的反应中间体,不能分离得到。常用二氯卡宾。卡宾的制法:
卡宾容易与双键发生加成反应,是顺式加成。
均聚:聚合反应只用一种单体参与聚合;共聚:聚合反应用两种或两种以上的单体参与聚合。例:7、聚合反应聚乙烯单体聚合物聚合度:聚合物中含单体的数目。
8、α—氢的反应α-碳sp3杂化α-氢sp2杂化1)α—氢的卤代反应注:反应属于自由基反应历程。hγ
注:此反应也属于自由基反应历程。实验室中,经常用N–溴代丁二酰亚胺(NBS)为溴化剂。NBS
丙烯醛丙烯酸2)α-氢的氧化反应丙烯腈
2、烯烃的实验室制法1)由醇脱水五烯烃的来源和制法1、烯烃的工业来源和制法2)一卤代烷脱卤化氢3)邻二卤代烷脱卤素4)炔烃的催化加氢
本章要求:1、熟练掌握烯烃的结构和命名;2、熟练掌握烯烃的加成反应,特别是亲电加成反应;3、掌握烯烃的氧化反应;4、了解烯烃的聚合反应。作业:3、1)3)4)5)6)8)5、3)6、1)4)7、9、1)2)
练习题命名下列化合物2,6-二甲基-3,6-二乙基辛烷2Z,4E,6Z-3-乙基-4-氯-2,4,6-辛三烯'
您可能关注的文档
- 20雪孩子-优秀完整课件PPT
- 法学专业民法学课件PPT之民法总论
- 《王二小的故事》课件PPT[1]
- 《葡萄沟》课件PPT
- 液位仪表培训课件PPT课件
- 游戏作文成语课件PPT
- 人教版五年级语文上册单元回顾与拓展三课件PPT
- 人教版小学语文二年级上册第2课《黄山奇石》课件PPT
- 烟花爆竹作业安全技术规程课件PPT
- 八月十五中秋主题队会课件PPT
- 各种各样的交通工具课件PPT
- 中职英语课件PPT
- 猫咪宠物可爱趣味俏皮幽默产品介绍个人总结教师课件PPT模板
- 2016年最新经典传统文化《中庸》课件PPT
- 环境标准教学课件PPT
- 现代推销学课件PPT3推销团队管理
- 现代推销学课件PPT5推销洽谈技术
- 现代推销学课件PPT8推销顾客管理