- 1.89 MB
- 2022-04-29 14:22:55 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'九年级化学中考复习专题四-金属和金属材料
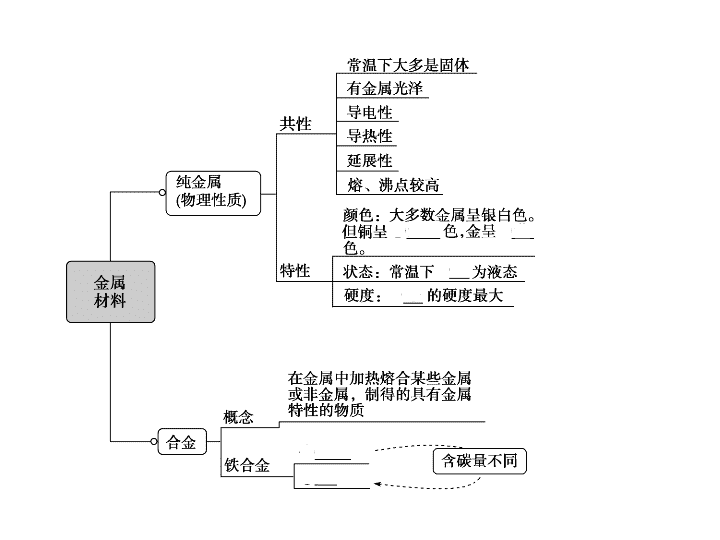
知识要点金属材料
3.金属与盐溶液反应一些金属可与某些盐溶液反应生成盐和金属。如(1)铁与硫酸铜溶液:_________________________。(2)铜与硝酸银溶液:______________________________。(3)铝与硫酸铜溶液:______________________________。Fe+CuSO4===FeSO4+CuCu+2AgNO3===Cu(NO3)2+2Ag2Al+3CuSO4===Al2(SO4)3+3Cu
4.金属的活动性顺序(1)金属活动性强弱的顺序为:_________________________________________________________________;(2)应用①在金属活动性顺序里,金属的位置越靠前,它的活动性越强;②位于氢前面的金属能置换出盐酸、稀硫酸中的氢;③位于前面的金属能把位于其后面的金属从它们的盐溶液里置换出来。K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
【方法指导】巧记金属与酸、与盐溶液反应的两个条件1.金属与酸反应的条件:氢前金属能置氢,氢后金属则不行;2.金属与盐溶液反应的条件:前金换后金,盐须溶于水。
1.一氧化碳还原氧化铁实验金属资源的利用和保护
2.工业炼铁在高温条件下,利用CO从铁的氧化物中将铁还原出来高炉【警示】原料中焦炭的主要作用是:提供热量和还原剂CO;石灰石的主要作用是:造渣,除去铁矿石中的SiO2。工业炼铁的产物是生铁而不是纯铁。
3.金属资源的保护与空气中的氧气和水蒸气反应隔绝空气或水洁净干燥保护膜防止金属锈蚀回收利用废旧金属
【温馨提示】证明CO还原铁矿石的产物中含有铁粉的方法1.物理方法:用磁铁吸引。2.化学方法:取少量产物加入装有稀盐酸或稀硫酸的试管中,有气泡产生则是铁粉。
易错点一 铜能把银从氯化银中置换出来剖析:只有排在前面的金属才能把排在后面的金属从其化合物的溶液中置换出来,而氯化银不溶于水,故铜不能把银从氯化银中置换出来。易错防范
易错点三 认为下列化学方程式正确
易错点四 金属与盐溶液或者酸溶液反应后滤液和滤渣成分的判断剖析:先将溶液中所涉及的金属和加入的金属按金属活动性由强到弱排列,排在单质金属前面的金属离子不能被置换,所以溶液中一定存在这些离子;越不活泼的金属会优先被置换出来,所以滤渣中有不活泼的金属单质,至于有几种还要看加入的金属的质量:若加入的金属单质过量,则滤渣中有该金属单质以及排在它后面的所有金属的单质,滤液中则有排在它前面
的金属离子及其本身的离子。如加入的金属单质不足,则排在它后面的金属也不能被全部置换出来,越不活泼的金属先被置换出来,滤渣就只有被置换的金属,滤液中就会包括排在单质金属前面金属离子及加入的金属的离子和没有被置换的不活泼的金属离子。
【突破指南】验证金属活动性顺序的方法1.通过金属与O2反应的难易程度进行判断,越活泼的金属越易与O2反应,越易锈蚀。2.通过金属能否与稀硫酸或稀盐酸反应以及与酸反应的速率进行判断,越活泼的金属与酸反应速率越快。3.通过金属与盐溶液的反应情况进行判断;若金属A能把金属B从其盐溶液中置换出来,则该金属A的活动性比金属B强。根据实验事实判断金属活动性的强弱
【典例1】(2014·江苏盐城,13,2分)现有X、Y、Z三种金属,已知:①X+YCl2===XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有Y和稀硫酸反应。这三种金属的活动性由强到弱的顺序是()A.X>Z>YB.Z>Y>XC.Y>Z>XD.X>Y>Z
【即时小练1】如图所示是X、Y、Z三种金属在容器中的反应现象,下列说法正确的是()A.X、Y、Z三种金属均发生了置换反应B.三种金属的活动性顺序是X>Y>ZC.若Z能从金属Y的盐溶液里置换出Y,则三种金属的活动性顺序是X>Z>YD.若X为金属镁,则Z可能是铁
【突破指南】金属与酸反应图象题的解题技巧对于金属与酸反应的图象题,错误率较高的原因是不识图。突破本类试题应抓住两点:一是开始阶段产生氢气的速率。此点反应在坐标图中的倾斜线上,倾斜线的角度越大,表示金属与酸反应的速率越快;影响金属与酸反应速率的因素主要是金属的活动性,金属活动性越强,产生氢气的速率越快。有关金属与酸反应的图象题
二是反应结束时得到氢气的质量。此点反应在坐标图中的水平线上,水平线越高,说明反应后生成的氢气越多;常用五种金属等质量与酸完全反应生成H2的质量由多到少为:Al>Mg>Na>Fe>Zn。
将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是A.反应结束后镁一定有剩余B.反应消耗盐酸的总质量一定相等C.0~t1时段,产生氢气的质量镁比铁大D.0~t2时段,参加反应的镁的质量与铁相等
一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如右图所示,下列说法不正确的是()A.t1时,产生氢气的质量锌比铁大B.t1时,产生氢气的速率锌比铁大C.t2时,参加反应锌的质量与铁相同D.t2时,锌、铁消耗的盐酸质量相同
探究三种金属的活动性顺序的方法判断三种金属的活动性顺序,一般采用“取中”原则;具体的步为:1.将要验证的金属按活动性顺序排列。2.选择三种金属中活动性居于中间的金属单质,两头的金属用其可溶性盐溶液。3.选择中间金属,将中间金属放入两头金属的盐溶液中。如验证Mg、Fe、Cu的活动性顺序,选用的试剂为:Fe、CuCl2溶液、MgCl2溶液或Mg、Cu、FeCl2溶液。可简记为“两金夹一盐”或“两盐夹一金”。选择试剂验证金属的活动性顺序
用置换反应验证铁的金属活动性比铜强,下列各组药能达到目的的是()A.Ag、FeSO4、CuSO4B.Fe、Cu、H2SO4C.Fe、Cu、ZnSO4D.Fe、Cu、KOH
小明设计实验探究铁、铜、银三种金属的活动性顺序,他设计了四个实验方案,分别选择的试剂是:①铜、银、硫酸亚铁溶液;②铁、银、硫酸铜溶液;③银、硫酸亚铁溶液、硫酸铜溶液;④铜、硫酸亚铁溶液、硝酸银溶液。上述四个方案所选试剂正确的()A.②④B.①②③C.①②③④D.②③
金属制品的防锈原理和方法1.防锈原理:铁制品锈蚀是因为铁与空气中的水和氧气共同作用的结果,因此防止铁生锈的原理就是隔绝空气或隔绝水。
2.防锈方法
3.除锈方法物理方法:用砂纸打磨等。化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl===2FeCl3+3H2O或Fe2O3+3H2SO4===Fe2(SO4)3+3H2O。
一次函数图像的应用(一)
学习目标:1、我能通过函数图象获取信息;2、我能利用函数图象解决简单的实际问题;3、我知道一元一次方程与一次函数的关系。
交流指导:1、各组按A组(1、3、5号)和B组(2、4、6号)各自对照导学案纠正疑难。(2分钟)2、各组交流预习指导和预习应用里的问题。(4分钟)3、根据老师的分工讨论所要解决的问题,必要时可快速地配上规范的板书,便于展示时使用。
一元一次方程0.5x+1=0与一次函数y=0.5x+1有什么联系?1.从“数”的方面看,当一次函数y=0.5x+1的函数值y=0时,相应的自变量的值即为方程0.5x+1=0解。2.从“形”的方面看,函数y=0.5x+1与x轴交点的横坐标,即为方程0.5x+1=0的解。2013123-1-2-3-1xy议一议
谈谈你的收获:
当堂训练:必做题:课本200-201页第1、2、3题选做题:导学案上1-2题'
您可能关注的文档
- 最新九年义务教育五年制小学语文第三册-5---坐井观天课件PPT.ppt
- 最新九年义务教育五年制数学第八册-质数和合数课件PPT.ppt
- 最新九年级上册中学美术《剪纸艺术》课件课件PPT.ppt
- 最新九年级unit6-Section-A-2课件PPT.ppt
- 最新九年级化学上册期末复习精炼第六单元碳和碳的氧化物专题五二氧化碳的性质课件课件PPT.ppt
- 最新九年级化学43水的组成课件PPT.ppt
- 最新九年级中考质量和密度复习课件PPT.ppt
- 最新九年级初三第一学期期中考试后家长会课件PPT分解PPT课件.ppt
- 最新九年级化学人教版下册第十一单元课题二《化肥》课件-2课件PPT.ppt
- 最新九年级化学过滤和结晶2课件PPT.ppt
- 最新九年级化学第四单元物质构成的奥秘总复习课件课件PPT.ppt
- 最新九年级化学第十单元-酸和碱总复习课件PPT课件.ppt
- 最新九年级化学酸碱盐复习获奖课件PPT课件.ppt
- 最新九年级思想品德不言代价与回报课件.课件PPT.ppt
- 最新九年级政治全册 第1单元 第1课 第2框 不言代价与回报配套课件 新人教版课件PPT.ppt
- 最新九年级物理-五能量的转化和转移课件-人教新课标版课件PPT.ppt
- 最新九年级数学二次根式的加减2课件PPT.ppt
- 最新九年级数学下册-三角函数课件-新人教版课件PPT.ppt