- 3.08 MB
- 2022-04-29 14:44:30 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'15-无机化学-第十五章-碳族元素
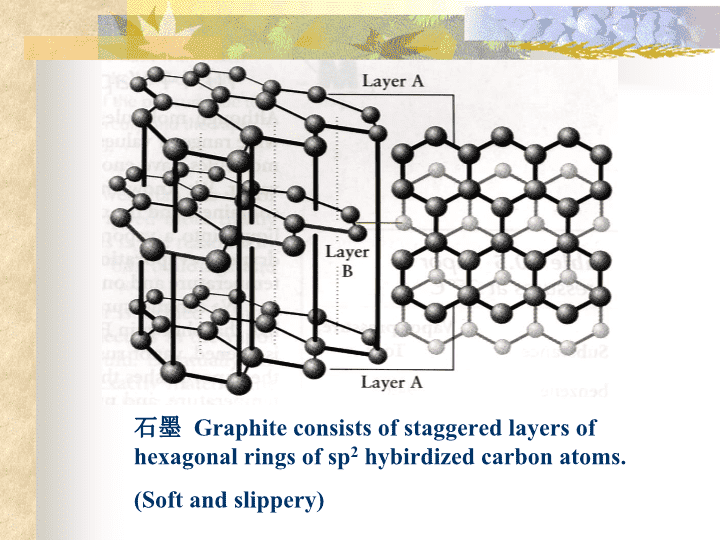
石墨Graphiteconsistsofstaggeredlayersofhexagonalringsofsp2hybirdizedcarbonatoms.(Softandslippery)
Quartz(石英)quartzite(石英岩)cristobalite(方石英)Threeofthecommonformsofsilica,SiO2
SiO4tetrahedraCristobalite(方石英)Diamond(钻石)
Thebasicstructuralunitofthemineralscalledpyroxenes(辉石).ConsistingofchainsofSiO4units.4H3O+(aq)+SiO44-(aq)+xH2O(l)→SiO2(s).xH2O(gel)+6H2O(l)硅胶,高比表面(ca.700m2/g),干燥剂、催化剂载体,色谱柱填料
Asbestos(石棉)ConsistoflongchainsbasedonSiO4tetrahedra.镁硅酸盐,纤维素矿物质形式,不燃、抗化学变化,用作防火,电绝缘,建筑材料。Thealuminosilicatemica(云母)铝硅酸盐矿物群的总称,常见于火成岩和变质岩中,易裂成柔软的薄片,用于绝缘体及电气设备中。
光纤opticalfiber(光学纤维的简称,光电信息传输)分子筛(吸附除杂)
Carborundum碳化硅,金刚砂:一种晶体磨料
本章讲解内容第一节碳族元素的通性第二节碳族元素的单质及其化合物第三节无机化合物的水解性
碳硅锗锡铅锗分族相似性课本p726第一节碳族元素的通性
1.基本性质CSiGeSnPb价电子构型:ns2np2主要氧化态稳定性:+2小大+4大小原子半径:小大I1大小~(相近)EA1/kJ·mol-1122>120>116<121>100X(Pauling)2.551.902.011.962.33
2、C与Si的比较
1、碳的同素异形体一、碳单质金刚石石墨富勒烯石墨烯第二节碳族元素的单质及其化合物2-1碳单质及其化合物课本p729结构特点参见p730-732
金刚石是原子晶体,其中C以sp3杂化轨道与其它原子相连,形成了牢固的C—C键。金刚石晶体透明、折光、耐腐蚀,硬度是所有物质中最大的可达10000kg/mm2,俗称钻石,除作装饰品外,还用于制造钻探用的钻头和磨削工具。
根据△G°=△H°T△S°,可作出和碳相关的氧化反应的热力学关系图:(P732图15-6,T、P、V)2、冶金工业中的碳还原反应:解释直线斜率不同的原因是什么?
3、金刚石的人工合成从理论上讲,高温高压能使石墨C转变成金刚石C。热力学上,用压强变化对△G的影响的公式来计算得。综合考虑后:实际上一般采用1600—1800K高温,6.0×109Pa高压。其一、溶剂说:石墨先溶解在溶剂-金属催化剂中,成为单个C原子,然后在冷却时直接生成金刚石。石墨向金刚石转化的机理,一般有两种说法:
二、碳的化合物CO的结构:与N2是等电子体。1、氧化物其二、固相转化说:石墨的碳原子间的键不发生断裂而在催化剂的作用下,按一定方向滑移,直接转化成金刚石结构。碳有许多氧化物,已见报道的有CO、CO2、C3O2、C4O3、C5O2,C12O8等,最常见的是CO、CO2。CO的结构:C=OC—O••••::
形成化合物:Fe(CO)5、Co2(CO)8、Ni(CO)4CO的化学性质:①加合作用与血红蛋白Hb形成加合物,是(Fe—CO)结合O2的几百倍,使Hb失去了输送O2的功能。空气中若有1/800体积的CO,就可使人在半小时内死亡。CO的分子轨道式为:[KK(σ2s)2(σ2s*)2(πy2p)2(πz2p)2(σ2p)2]
②还原性CO在高温时,可还原一些金属氧化物:FeO+CO=Fe+CO2ZnO+CO=Zn+CO2在常温下,CO可使一些化合物中的金属离子还原:CO+PdCl2+H2O=CO2+Pd↓+2HClCO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3
问题:设计一个实验证明CO2中有CO?气体样品通入PdCl2溶液,若出现黑色沉淀,证明有COPdCl2(aq)+2CO(g)+H2OPd↓+CO2↑+2HCl气体通入澄清的石灰水,若出现白色沉淀,后又澄清,即证实有CO2CO2+Ca(OH)2=CaCO3+H2OCaCO3+H2O+CO2=Ca(HCO3)2问题:设计一个实验证明CO中有CO2?
③CO与其它非金属的作用:④CO与碱作用:Cr2O3·ZnO,623-673KCO+2H2==================CH3OHFe,Co或Ni523K,101KPaCO+3H2==================CH4+H2O活性碳CO+Cl2======COCl2(光气,有毒)473KCO+NaOH=====HCOONaCO是甲酸的酸酐,因此甲酸脱水可制得CO。
CO2结构:曾认为CO2的结构为O=C=O.O---C---O但经测定,其键长介于三键和双键之间,其结构应为:••••••••::C采取sp杂化,形成两个sp-ps键,另有两个p34离城键。CO2化学性质:不活泼,高温下可与Mg、Al等反应。2Mg+CO2==2MgO+CNH3+CO2+H2O==2NH4HCO3解释CO2不能扑救金属着火的原因是什么?
CO32-与NO3-是等电子体;HCO3-与HNO3也是等电子体。碳酸根的结构:COOO….….….COHOOH2-正盐sp2碳酸COHOO….….-酸式盐sp2∏462、碳酸和碳酸盐∏34
H2CO3H++HCO3-①二元弱酸:K1=4.2*10-7K2=5.6*10-11HCO3-H++CO32-②溶解性:NH4+、Na+、K+等的正盐易溶;NH4+、Na+、K+等碱金属离子的碳酸氢盐比正盐的溶解度小(氢键因素);其它阳离子如:Ca2+、Ba2+、Pb2+等的正盐难溶,但其酸式盐易溶(符合共价性及离子间引力)。试解释溶解度差别的原因是什么?p746
所以,当其它金属离子与可溶性的碳酸盐相遇时,会产生不同的产物。可能是:碳酸盐、碱式碳酸盐、氢氧化物。碱金属的碳酸盐,水解显强碱性。碳酸氢盐NaHCO3、KHCO3等,水解显弱碱性。③水解性:CO32-+H2O==HCO3-+OH-HCO3-+H2O==H2CO3+OH-
b、氢氧化物碱性较弱的金属离子可沉淀为碱式碳酸盐。也有的书上讲,其氢氧化物和碳酸盐的溶解度相差不多,则可能得到碱式碳酸盐。c、若金属离子水解性极强,其氢氧化物的溶度积小将得到氢氧化物。a、其氢氧化物碱性较强的金属离子可沉淀为碳酸盐。究竟以何种沉淀出现,主要规律如下:Ba2++CO32-=BaCO3↓2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
3、碳的硫化物和卤化物(略,自学)与阳离子的极化能力有关,阳离子对CO32-反极化能力越强,碳酸盐的热稳定性越差,H+的极化作用比一般金属离子都强,所以有以下顺序:④热稳定性:热稳定性:正盐>酸式盐>酸碱金属盐>碱土金属盐>重金属盐另外:碱土金属盐稳定性随金属原子半径的增大而增强
单质硅的晶体结构类似于金刚石,Si采取sp3杂化轨道成键。2-2硅及其化合物1、用途:高纯度的硅是良好的半导体材料,其导电性随温度升高而增强,与导体相反。大量的Si用于钢铁工业,含Si的合金具有抗化学腐蚀性质。一、单质硅:
2、性质:与非金属的反应Si+2F2==SiF4Si+2Cl2=SiCl4Si+O2==SiO23Si+2N2====Si3N4Si+C==SiC△△△1573K
与酸碱作用:3Si+4HNO3+18HF=3H2SiF6+4NO↑+8H2OSi+2NaOH+H2O=Na2SiO3+2H2↑与金属的反应:高温Si+Fe=====FeSi
3、制法:2C+SiO2===Si+2CO(3273K)Si(粗硅)+2Cl2===SiCl4(723-773K)SiCl4+2H2===Si(纯)+4HCl(电炉)SiH4=Si(纯)+2H2(△)Si(粗硅)+3HCl==SiHCl3+HCl(523-573K)SiHCl3+H2==Si(精硅)+3HCl
SiH4+2O2=======SiO2+2H2OSiH4+2KMnO4====2MnO2↓+K2SiO3+H2↑+H2O此反应可以检测硅烷的存在二、硅烷燃烧1、性质:
所有硅烷的热稳定性都较差,分子量愈大,稳定性愈差,一般高级硅烷分解为低级硅烷,低级硅烷分解为单质Si。易分解:硅烷在纯水中不发生水解作用,但水中有微量OH-存在时,由于OH-的催化作用,水解反应激烈进行。水解性:SiH4=Si+2H2(△)SiH4+(n+2)H2O==SiO2·nH2O↓+4H2
1、制取:2、制法:SiO2+4Mg==Mg2Si+2MgOMg2Si+4HCl=SiH4↑+2MgCl22Si2Cl6+3LiAlH4=2Si2H6+3LiCl+3AlCl3三、硅卤化物和氟硅酸盐SiO2+4HF=SiF4↑+2H2OSiO2+2CaF2+2H2SO4=SiF4↑+2CaSO4+2H2O
2、SiX4的水解性:SiO2+2C+2Cl2=SiCl4+2COSi+2Cl2=SiCl4SiCl4+3H2O=H2SiO3+4HClSiF4+3H2O=H2SiO3+4HFSiF4+2HF=H2SiF6氟硅酸是一强酸,在溶液中以H+和SiF62-离子形式存在。思考:SiCl4、SiF4的水解产物有何不同?为什么碳的卤化物不水解,而硅的卤化物却容易水解呢?
制备:3、氟硅酸盐3SiF4+2Na2CO3+2H2O=2Na2SiF6↓+H2SiO4+2CO2SiF4+2KF=K2SiF6四、硅的含氧化合物:1、二氧化硅
SiO2与CO2的结构截然不同,为三维空间网络结构的原子晶体,Si:O最简比为1:2。SiO2+2Mg=Si+2MgO(高温)SiO2+4HF=SiF4↑+H2OSiO2+2NaOH=Na2SiO3+H2OSiO2+Na2CO3====Na2SiO3+CO2↑(熔融)天然SiO2晶形:石英、方石英、水晶、玛瑙等;无定形:硅藻土。性质
制备2、硅酸SiO44-+4H+=H4SiO4↓H2O+H2SiO3↓脱水性:H4SiO4与H3PO4有相似之处,可以脱水形成一系列产物,组成随形成条件而不同,参看P749。p747
H4SiO4单分子形式硅酸溶胶硅酸凝胶硅胶放置脱水缩合加酸电解质烘干活化CoCl2浸泡烘干变色硅胶硅酸是二元弱酸:K1=2×10-10K2=1×10-12硅胶的制备简图白色透明软而富有弹性固体p747
用途:建筑工业及造纸中是粘合剂,木材或织物用水玻璃浸泡后可防腐、防火,浸过鲜蛋可长期存放。Na2SiO3还用作软水剂,洗涤剂,肥皂填料,制硅酸原料,用20%的水玻璃可以做“水中花园”实验。(1)可溶性硅酸盐的代表是Na2SiO3,俗称水玻璃,泡花碱。不可溶的:天然硅酸盐可溶性的:碱金属硅酸盐3、硅酸盐分类
(2)天然硅酸盐在地壳中的含量较多,这些硅酸盐都是难溶的,其基本结构单元都是SiO4四面体,P749。(1)(2)(3)(4)
(5)(6)(7)
人工分子筛是用Na2SiO3、NaAlO2、NaOH、水,按一定比例合成的。网络状的硅酸盐和铝硅酸盐具有笼形结构,这些笼可以有选择地吸附一定大小的分子,这种作用称分子筛作用。(3)分子筛——合成铝硅酸盐沸石型分子筛:铝硅酸盐,用作吸附剂。
1、冶炼:2-3锗、锡、铅及其化合物一、Ge、Sn、Pb的冶炼、性质和用途GeO2+2H2===Ge+2H2O(△)SnO2+2C==Sn+2CO↑(△)SnS+O2==2SnO2+2SO2(焙烧)另外,以H2SnF6和H2SnO4作为电解液,用电解精炼的方法制取纯锡。
2PbS+3O2==2PbO+2SO2(焙烧)PbO+C==Pb+CO↑(△)PbO+CO==Pb+CO2(△)PbS+Fe==Pb+FeS(△)另外,以粗铅为阳极,PbSiF6为电解液,精炼得到纯Pb。
Ge是一种灰白色脆性金属,它的晶体结构是金刚石型,熔点较高1210K,多用于半导体材料。单质Sn有三种同素异形体:灰锡,白锡和脆锡。2、性质和用途:锡制品若在寒冬中长期处于低温会自行毁坏,毁坏是从某一点开始,然后迅速蔓延,称为锡疫。铅是质软、强度不高的金属,密度很大,仅次于汞和金。铅主要用来制造合金,铅蓄电池电极材料,用于X-射线防护材料;铅板及保护电缆线的铅皮,铅管等。
*②这些金属与O2反应都形成一层致密的氧化膜,保护内部金属不被继续氧化。*①Pb与稀HCl、H2SO4都能反应,但因生成的产物难溶覆盖在Pb表面,致使反应终止。Ge和Sn的化学性质相似,但Pb的化学性质与前二者有所差别:*③这些金属一般不与H2O反应。(H2在Sn、Pb上的超电压大)
SnO2稳定,溶于碱,难溶于酸,不溶于水。随着原子序数的增加,氧化物碱性增强,随着原子的电荷数的增大其碱性减弱。(碱性可理解为O得质子的能力)二、氧化物和氢氧化物:SnO2+2NaOH==Na2SnO3+H2OSnO2+2Na2CO3+4S==Na2SnS3+Na2SO4+CO2↑1、氧化物:
PbO是两性偏碱性的氧化物。铅的化合物有多种:Pb3O4铅丹&红丹,其组成为2PbO·PbO2,它属于铅盐结构类型Pb2[PbO4]。高价铅的氧化物加热会逐渐分解为低价氧化物:563-593K663-693K803-823KPbO2────Pb2O3────Pb3O4────PbPbO+2H+=Pb2++H2OPbO+KOH+H2O=KPb(OH)3
*用上述方法可证实Pb3O4中有Pb4+和Pb2+PbO2是两性氧化物:Pb3O4+4HNO3=PbO2↓+2Pb(NO3)2+2H2OPbO2+2NaOH+2H2O===Na2Pb(OH)6(△)以上是因惰性电子对效应,PbO2表现出较强的氧化性。PbO2+4HCl==PbCl2+Cl2↑+2H2O(△)2PbO2+2H2SO4==PbSO4+O2↑+2H2O(△)2Mn(NO3)2+5PbO2+6HNO3=2HMnO4+5Pb(NO3)2+2H2OPb(OH)3-+ClO-=PbO2+Cl-+OH-+H2O
问题:铅有四种氧化物:PbO,Pb2O3,PbO2,Pb3O4,请设计一个实验,证明Pb3O4化合物中铅的不同价态。在稀硝酸中加入少量的Pb3O4,使之充分反应:Pb3O4+4HNO3=PbO2(棕色)+Pb(NO3)2+2H2O过滤,将棕色沉淀与滤液分离。在滤液中加入K2CrO4溶液,产生黄色沉淀,Pb2++CrO42-=PbCrO4可证明Pb3O4中含有Pb(II);3.棕色沉淀用硝酸酸化后加入Mn2+离子溶液,反应后溶液显紫红色,5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O可证明Pb3O4中含有Pb(IV)
2、氢氧化物:亚锡酸根离子是一种良好的还原剂(+4价的锡稳定)Sn(OH)2是两性氢氧化物,即溶于酸又溶于碱。Ge、Sn、Pb的氢氧化物酸碱性的变化规律和对应的氧化物酸碱性变化规律相似。Sn(OH)2+2HCl=SnCl2+2H2OSn(OH)2+2NaOH=Na2[Sn(OH)4]3Na2Sn(OH)4+2Bi(OH)3=2Bi↓+3Na2Sn(OH)6
Sn(OH)4又称锡酸,有a、β两种变体:a型:无定型既溶于酸又溶于碱:型:不溶于强酸也不溶于强碱,晶体性质稳定。Sn(OH)4+2NaOH=Na2Sn(OH)6Sn(OH)4+4HCl=SnCl4+4H2OSnCl4+4NH3·H2O=Sn(OH)4↓+4NH4Cl(a-锡酸)Sn+4HNO3(浓)======H2SnO3↓+4NO2↑+H2O(-锡酸)实验室可制得a型、β型锡酸:
Ge分族可以形成两类化物:MX4:主要表现为共价化合物MX2:主要表现为离子化合物1、氧化还原性:三、卤化物2HgCl2+SnCl2=SnCl4+Hg2Cl2↓(白色)Hg2Cl2+SnCl2=SnCl4+2Hg↓(黑色)该反应较为灵敏常用来检验Sn2+、Hg2+的存在。
2、水解性:PbCl4不稳定,是较强氧化剂,易分解为PbCl2和Cl2。而PbBr4、PbI4不存在。SnCl2+H2O=Sn(OH)Cl↓+HClSnCl4+4H2O=Sn(OH)4+4HCl比较它们的水解性的大小?3、溶解性:PbCl2(白)、PbI2不溶于冷水,能溶于热水中,能溶于相应的酸和盐中,形成配离子。PbCl2+2HCl=H2[PbCl4]PbI2+2KI=K2[PbI4]
水解强度的大小取决于M+、A-对配位水分子的极化作用。极化作用越强,越易发生水解。第三节无机化合物的水解性一、盐类水解的实质M+A-+(x+y)H2O===[M(H2O)x]++[A(H2O)y]-水解的实质是用Ζ/r(离子极化能力的大小)来解释的,Ζ/r越大,离子的水解程度越明显。(离子势)
影响离子极化能力即是影响水解的因素:电荷↗、半径↙、18e、(18+2)e等离子水解度大,见p760表9。二、影响水解的因素Ζ/r越大,水解能力增加,即水解PKh越小。2、空轨道从水解本质可看出,阳离子要首先接受水分子,即:M+有空轨道,接受H2O氧上的孤对电子,形成配位键,同时使原有的HO-H键削弱、断裂,然后使水分解。因此,无空轨道的阳离子不能发生水解,如:CF4、CCl4等。1、电荷与半径:
阳离子的水解产物主要有以下几种:酸度影响水解平衡。温度升高,水解加强。3、外界因素三、水解的类型碱式盐SnCl2+H2O=Sn(OH)Cl↓+HClBiCl3+H2O=BiOCl↓+2HCl
结论:水解产物主要取决于阳离子的极化能力,极化能力越强水解越彻底,最终为氧化物的水合物(含氧酸)。另外,水解反应有时伴有其它反应而使产物复杂化,这些反应有聚合、配位、脱水和氧化还原等等……AlCl3+3H2O==Al(OH)3+3HClFeCl3+3H2O==Fe(OH)3+3HCl氢氧化物SnCl4+4H2O=Sn(OH)4+4HClPCl5+4H2O=H3PO4+5HCl含氧酸例如:Cr3+、Fe3+水解易形成多聚配阳离子。
SiF4+4H2O=H4SiO4+4HF2SiF4+4HF=4H++2SiF62-总反应:3SiF4+4H2O=H4SiO4+4H++2SiF62-类似:3SnCl4+3H2O=SnO2H2O+2H2[SnCl6]有时水解产物还可以继续与水解物发生配合作用:作业:P765-766:4,5,6,8,10,15,17,18,19
人生勃兰兑斯
一、作者简介勃兰兑斯(1842—1927),丹麦文学评论家,文学史家。重要著作还有1888年发表的《波兰印象记》和《俄国印象记》等。
瞻望()攫取()鲑鱼()停滞()臆测()馈赠()zhānjuéguīzhìkuìyì给下面的红体字注音
解释下面的词语:1停滞不前:2乐此不疲:3粉身碎骨:4赏心悦目:5微不足道:6瞻望:受到阻碍,不能顺利的进行和发展。喜欢做某事而不知疲倦。形容为了达到目的而不惜牺牲生命。指美好的情景使人心情愉快。事物细小而轻微,不值得一提。往远处或高处看。
一、整体把握课文以“高塔”“地洞”“广阔领域”和“工场”为喻,从不同的角度、视野,描述人的生命旅程的不同境况,表达了作者对人的生命本质、对人类社会生活的深刻理解,表达了他对生命的珍爱的情感,以及让一生过得更有意义的信念和志向
全文按所描写的场面自然地分为四个部分。第一部分(1~4段),描述人类攀登高塔的情景,说明人类生命表现形式尽管千差万别,但其中又有共同性和必然性。第二部分(5~6段),描述一些人深入地挖掘、探寻地下坑道的情景,表现他们不屈不挠、顽强奋斗的精神。第三部分(7段),描述一些人在广阔的领域开拓进取,他们攫取更多的土地,征服更多的人。表现他们勇敢顽强的精神。第四部分(8~9段),描述一些在一种工场中劳动的人们,表现他们的刻苦勤奋、吃苦耐劳的精神品质。
二、问题研究1.“越往上走,攀登越困难了,而且目光已不大能区别事物,它们看起来似乎都是相同的。”为什么说都是相同的?“往上走”意味着年龄的增长,越老经历的事越多,所以见到各种事物都“似曾相识”。2.“从精神上来说,他们是停留在同一个地方。”这话是什么意思?人们随年事的增高,自身在许多方面会有很多改变,但是性格、志趣、品质总是很难或很少改变的。这里的“精神”应指性格之类的东西。
3.在广阔的领域开拓进取的人具有怎样的性格特点?(试从两大方面来概括:)一是贪欲:占有欲极强,渴望征服,喜欢掌握权力,控制人和事物;二是坚强:精力充沛,头脑活跃,爱冒险,热爱生活,勇敢地面对生活的挑战。4.作者描述这些人群,肯定或赞扬了什么精神?作者想借此来肯定或赞扬这些人对时光的珍惜,对生命的热爱,赞扬勤于劳作的精神,辛苦探索的精神,勇敢倔强的精神……
5.“那像是一只可爱的手在转动沙漏计,从而延缓了它的转动。”“一只可爱的手”指什么?沙漏计为什么会延缓转动?“一只可爱的手”是指“一切亲切的思想”;至于沙漏计延缓转动,也可以从两方面理解,一是说他“没有时间去察看放在角落里的计时沙漏计”,全神贯注以致忘记了时间,所以时间仿佛被拉长了;一是说他在有生之年做了很多很多事,别人需要很长时间做的事,他在很短的时间里就做完了,收获甚丰,过得充实,所以时间仿佛被拉长了。
阅读5-7自然段,说说下列句子表现出的人物性格(或品质)1.他们熟悉那地下的世界,在迷宫般的坑道中探索道路,指导或是了解或是参与地下深处的工作,并乐此不疲,甚至忘记了岁月是怎样逝去的。热爱事业、全心投入、以苦为乐。2.当死神临近时,他们会像阿基米德在临死前那样提出请求:“不要弄乱我画的圆圈”。爱事业甚于生命
3.好像鲑鱼迎着激流,他们天赋的本性就是迎着岁月的激流热情奔放、敢于冒险、敢于挑战。4.他们利用岁月,因而岁月并不使他们厌倦。热爱生活、永葆活力
本文运用比喻的手法,以此代表人生各个方面的种种人:首先,作者把人生比作揭示人类追求生命的表现形式千变万化,又有相似性、一致性的特点。其次,用比喻从事研究工作,进行较为抽象脑力劳动的人们。再次,用征服的人比喻军事家、政治家。最后,作者用在工场劳动的人比喻作者运用比喻含蓄、贴切地表达自己对人生的看法,新颖、奇特、形象。攀登高塔挖掘坑道的人广阔领域技术工人、工艺师、设计师、发明家
学习了这篇文章,你想把人生比作什么?对照自己,想想你将怎样选择自己的人生”?'
您可能关注的文档
- 最新14我要的是葫芦ppt课件PPT.ppt
- 最新14差别课件PPT.ppt
- 最新14学会合作清晰课件PPT.ppt
- 最新14职称考试建筑构造与材料课件PPT.ppt
- 最新14章 电抽搐治疗、工娱治疗与精神康复课件PPT.ppt
- 最新15---凡卡ppt课件PPT.ppt
- 最新14风速和风向详解课件PPT.ppt
- 最新14邮票齿孔的故事课件PPT.ppt
- 最新14通往广场的路不止一条课件(公开课)ppt课件PPT.ppt
- 最新15-3-9研究影响平行板电容器电容的因素课件PPT.ppt
- 最新15-16版:1.1-生命的基础能源——糖类(创新设计)-(1)课件PPT.ppt
- 最新15-蒲公英的梦课件PPT.ppt
- 最新15-落花生ppt课件PPT.ppt
- 最新15.1.2分式的基本性质(2)【约分与通分】课件PPT.ppt
- 最新15.1.2-分式的基本性质-第2课时课件PPT.ppt
- 最新15.中药学课件(止血药)(2)课件PPT.ppt
- 最新15.中药学课件(止血药)(1)课件PPT.ppt
- 最新15.4-电流的测量(1)课件PPT.ppt