- 3.41 MB
- 2022-04-29 14:27:20 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'新课标人教版选修三《物质结构与性质》章分子结构与性质节分子的立体结构
三、杂化轨道理论简介二、价层电子对互斥理论(VSEPR模型)一、形形色色的分子第二节分子的立体结构四、配合物理论简介目录①分子的立体结构多种多样②红外光谱仪:测分子立体结构①无孤对电子分子的立体结构与VSEPR模型相同②有孤对电子分子的立体结构为VSEPR模型去掉孤对电子占据位置后的立体结构①sp3杂化②sp2杂化③sp杂化①配位健——一种特殊的共价键②配位化合物,含配位键的复杂离子或分子③复盐、混盐、配合物盐
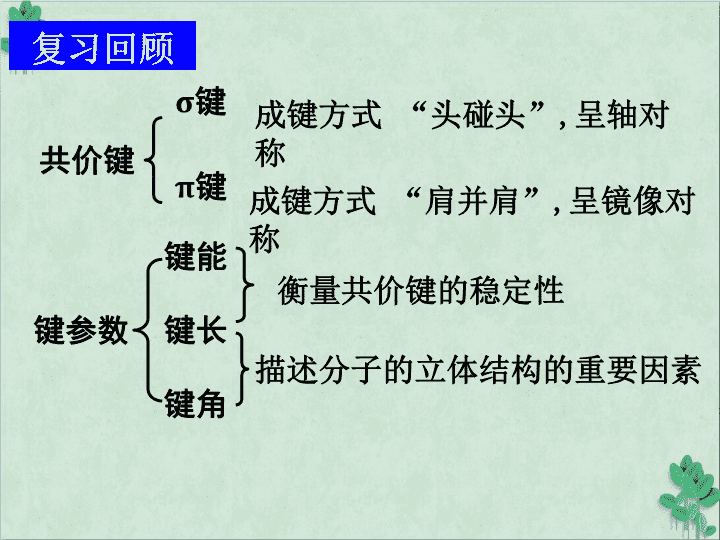
复习回顾共价键σ键π键键参数键能键长键角衡量共价键的稳定性描述分子的立体结构的重要因素成键方式“头碰头”,呈轴对称成键方式“肩并肩”,呈镜像对称
一、形形色色的分子O2HClH2OCO2
C2H2NH3CH2OP4一、形形色色的分子
CH4CH3CH2OHCH3COOHC6H6C8H8CH3OH一、形形色色的分子
C60C20C40C70一、形形色色的分子
写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间结构:OCO:::::::::::HOH::::HNH:H::HCH:O::::HCH:HHO=C=OH-O-HH-N-H-HH-C-H=OH-C-H--HH无有有无无直线形V形三角锥形平面三角形正四面体
科学视野分子的立体结构是怎样测定的?测分子立体结构:红外光谱仪→吸收峰→分析。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
思考:同为三原子分子,CO2和H2O分子的空间结构却不同,为什么?同为四原子分子,CH2O与NH3分子的空间结构也不同,为什么?二、价层电子对互斥理论(VSEPR模型)价层电子对互斥理论可判断
二、价层电子对互斥理论(VSEPR模型)1、要点:①对ABn型的分子或离子,中心原子A价层电子对(包括用于形成共价键的共用电子对和没有成键的孤对电子)之间存在排斥力,将使分子中的原子处于尽可能远的相对位置上,以使彼此之间斥力最小,分子体系能量最低。——预测分子结构的简单理论对称分布(原子的位置对称分布)―VSEPR模型
②价层电子对数求算方法:对于ABn分子,成键电子对数=n孤对电子对数=(A原子价电子数±离子电荷数-B化合价×n)÷2价层电子对数=成键电子对数+孤对电子对数(双键、叁键均按单键计算)二、价层电子对互斥理论(VSEPR模型)
③价层电子对互斥理论时,首先求算价层电子对数,确定VSEPR模型。然后再根据中心原子上有没有孤对电子,就可以判断分子的空间构型二、价层电子对互斥理论(VSEPR模型)无孤对电子分子立体结构与VSEPR模型相同有孤对电子分子立体结构为VSEPR模型略去孤对电子占据位置后的立体结构
2、价层电子对互斥模型把分子分成两类:(1)中心原子上的价电子都用于成键(无孤对电子)在这类分子中,由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离,成键原子的几何构型总是采取电子对排斥最小的那种结构。它们的立体结构可用中心原子周围的原子数来预测。二、价层电子对互斥理论(VSEPR模型)无孤对电子分子立体结构与VSEPR模型相同
直线形平面三角形正四面体BeCl2BF3CH4、CCl4二、价层电子对互斥理论(VSEPR模型)
三角双锥正八面体PCl5SF6二、价层电子对互斥理论(VSEPR模型)
(2)中心原子上有孤对电子的分子孤对电子也要占据中心原子周围的空间,并参与互相排斥二、价层电子对互斥理论(VSEPR模型)分子立体结构为VSEPR模型略去孤对电子占据位置后的立体结构
V型三角锥形V型PbCl2NH3H2O略去1对孤对电子占据位置后的立体结构为V型略去1对孤对电子占据位置后的立体结构为三角锥形略去2对孤对电子占据位置后的立体结构V型
计算:CO2、SO2、SO3、SO32-、SO42-价层电子对数、成键电子对数、孤对电子对数,并预测分子立体结构二、价层电子对互斥理论(VSEPR模型)详见表一
220213330直线形V型平面三角形表一无孤对电子与VSEPR模型相同为平面三角形无孤对电子与VSEPR模型相同为直线形略去1对孤对电子占据位置后的立体结构为V型
134440三角锥正四面体表一无孤对电子与VSEPR模型相同为正四面体略去1对孤对电子占据位置后的立体结构为三角锥形
2320AB2直线形HgCl230AB321AB2平面三角形BF3V形PbCl2二、价层电子对互斥理论(VSEPR模型)
440AB431AB322AB2正四面体CH4三角锥形NH3V形H2O二、价层电子对互斥理论(VSEPR模型)
5三角双锥50AB541AB432AB323AB2三角双锥变形四面体T形直线形仅作了解PCl5SF4ClF3
6八面体60AB651AB542AB4四方锥形IF5平面正方形仅作了解SF6八面体
注:价层电子对互斥模型对少数化合物判断不准,不能适用于过渡金属化合物,除非金属具有全满、半满或全空的d轨道二、价层电子对互斥理论(VSEPR模型)
C..H..H..HH....N......HHHCHHHHOHHCHHO=NHHHC=O=O23423000O..HH......21HH..C....O......C........OO........代表物思考并填写下列表格:电子式结构式中心原子结合的原子数中心原子孤对电子对数CO2CH2OCH4H2ONH3VR模型立体结构
应用反馈:0120100022233444直线形V形V型平面三角形三角锥形四面体正四面体正四面体PO43-04正四面体
思考与交流:P38
1、下列物质中,分子的立体结构与水分子相似的是()A、CO2B、H2SC、PCl3D、SiCl4B2、下列分子的立体结构,其中属于直线型分子的是()A、H2OB、CO2C、C2H2D、P4BC
3、为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型—价层电子对互斥模型。这种模型把分子分成两类:一类是;另一类是是。BF3和NF3都是四个原子的分子,BF3的中心原子是,NF3的中心原子是;BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是。无孤对电子有孤对电子无孤对电子有孤对电子略去1对孤对电子占据位置后的立体结构为三角锥形
值得注意的是价层电子对互斥模型只能解释化合物分子的空间构形,却无法解释许多深层次的问题,如无法解释甲烷中四个C-H的键长、键能相同及H-C-H的键角为10928′。因为按照我们已经学过的价键理论,甲烷的4个C-H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。三、杂化轨道理论简介
为了解决这一矛盾,鲍林提出了杂化轨道理论,2s2pC的基态2s2p激发态正四面体形sp3杂化态CHHHH109°28’激发(1)要点:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,得到4个能量相等、成分相同的sp3杂化轨道,夹角10928′,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的如下图所示:三、杂化轨道理论简介
三、杂化轨道理论简介①杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化②杂化轨道:原子轨道组合杂化后形成的一组新轨道③杂化轨道类型:sp、sp2、sp3等杂化结果:重新分配能量和空间方向,组成数目相等成键能力更强的原子轨道④杂化轨道用于形成σ键和容纳孤对电子(2)几个概念
2s2pC的基态2s2p激发态正四面体形sp3杂化态CHHHH109°28’激发①sp3杂化三、杂化轨道理论简介
①sp3杂化sp³杂化:夹角为109°28'的正四面体形四个杂化轨道。
碳的sp2杂化轨道sp2杂化:三个夹角为120°的平面三角形杂化轨道。②sp2杂化
C2H4②sp2杂化三、杂化轨道理论简介
sp杂化:夹角为180°的直线形杂化轨道。③sp杂化三、杂化轨道理论简介
乙炔的成键三、杂化轨道理论简介
大π键C6H6③sp杂化三、杂化轨道理论简介
基态N的最外层电子构型为2s22p3,在H影响下,N的一个2s轨道和三个2p轨道进行sp3不等性杂化,形成四个sp3杂化轨道。其中三个sp3杂化轨道中各有一个未成对电子,另一个sp3杂化轨道被孤对电子所占据。N用三个各含一个未成对电子的sp3杂化轨道分别与三个H的1s轨道重叠,形成三个N―H键。由于孤对电子的电子云密集在N的周围,对三个N―H键的电子云有比较大的排斥作用,使N―H键之间的键角被压缩到,因此NH3的空间构型为三角锥形。
基态O的最外层电子构型为2s22p4,O采用sp3不等性杂化,形成四个sp3杂化轨道,其中两个杂化轨道中各有一个未成对电子,另外两个杂化轨道分别被两对孤对电子所占据。O用两个各含有一个未成对电子的sp3杂化轨道分别与两个H的1s轨道重叠,形成两个键。由于O的两对孤对电子对两个键的成键电子有更大的排斥作用,使键之间的键角被压缩到,因此H2O的空间构型为角型。
1、看中心原子有没有形成双键或叁键,如果有1个叁键,则其中有2个π键,用去了2个p轨道,形成的是sp杂化;如果有1个双键则其中有1个π键,形成的是sp2杂化;如果全部是单键,则形成的是sp3杂化。2、没有填充电子的空轨道一般不参与杂化.三、杂化轨道理论简介
根据以下事实总结:如何判断一个化合物的中心原子的杂化类型?C-Csp3sp2spC=CC≡C
①杂化轨道只用于形成σ键或者用来容纳孤对电子②杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数
代表物杂化轨道数杂化轨道类型分子结构CO2CH2OCH4SO2NH3H2O结合上述信息完成下表:0+2=2SP直线形0+3=3SP2平面三角形0+4=4SP3正四面体形1+2=3SP2V形1+3=4SP3三角锥形2+2=4SP3V形孤对电子数000112
科学探究1、写出HCN分子和CH2O分子的路易斯结构式。2.用VSEPR模型对HCN分子和CH2O分子的立体结构进行预测(用立体结构模型表示)HCN价层电子对数2,无孤对电子直线型CH2O价层电子对数3,无孤对电子平面三角型
3.写出HCN分子和CH2O分子的中心原子的杂化类型。4.分析HCN分子和CH2O分子中的π键。科学探究HCN:C原子sp杂化:直线型CH2O:C原子sp²杂化:平面三角型
1、下列分子中的中心原子杂化轨道的类型相同的是()A.CO2与SO2B.CH4与NH3C.BeCl2与BF3D.C2H2与C2H4B课堂练习
课堂练习2、指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。(1)PCl3(2)BCl3(3)CS2
3、写出下列分子的路易斯结构式(是用短线表示键合电子,小黑点表示未键合的价电子的结构式)并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。(1)PCI3(2)BCl3(3)CS2(4)C12O(1)PCI3:SP3三角锥形..PCICI解析:............CI......CI....(2)BCl3:SP2平面三角形BCI........Cl......(3)CS2:SP直线形C=S=S........(4)C12O:SP3V形∶O∶Cl......CI......
直线形平面三角形正四面体平面长方形直线形∶O=C=O∶‥‥╱╲B▏FFFsp杂化sp²杂化sp³杂化sp²杂化sp杂化
sp³杂化sp³杂化sp²杂化sp³杂化sp³杂化正四面体正四面体平面三角形V形三角锥形
(1)配位健——一种特殊的共价键配位键:一方是能够提供孤对电子的原子,另一方是能够接受孤对电子的空轨道的原子间形成的“电子对给予---接受键”四、配合物理论简介:H3O+:H+H3O+H2O+NH4+:NH3+H+NH4+H-O←H-H[]+H-N←H--HH[]+
蓝色蓝色蓝色无色无色无色四、配合物理论简介:实验2-1固体颜色溶液颜色CuSO4CuCl2.2H2OCuBr2NaClK2SO4KBr白色绿色深褐色白色白色白色思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?CuOH2H2OH2OH2O2+
(2)配位化合物,简称配合物,通常是由中心离子(或原子)与配位体(某些分子或阴离子)以配位键的形式结合而成的复杂离子或分子。四、配合物理论简介:
2+CuNH3H3NNH3NH3实验2-2已知氢氧化铜与足量氨水反应后溶解是因为生成[Cu(NH3)4]2+,其结构简式为:试写出实验中发生的两个反应的离子方程式?四、配合物理论简介:Cu2++2NH3.H2OCu(OH)2+2NH4+Cu(OH)2+4NH3.H2O[Cu(NH3)4]2++2OH—+4H2O蓝色沉淀深蓝色溶液
实验2-3练习书写:向硝酸银溶液中逐渐滴加氨水的离子方程式Fe3++SCN—[Fe(SCN)]2+硫氰酸根血红色四、配合物理论简介:
配合物的组成四、配合物理论简介:
①复盐:由两种或两种以上的阳离子与一种酸根离子组成的盐叫做复盐。如:KAl(SO4)2·12H2O②混盐:是指一种金属离子与多种酸根离子所构成的盐。如氯化硝酸钙[Ca(NO3)Cl]③配合物盐:是在配合物的溶液或晶体中,十分明确地存在着含有配位键的、能独立存在的复杂组成的离子:[Cu(NH3)4]SO4[Cu(NH3)4]2++SO42-(3)复盐、混盐、配合物盐四、配合物理论简介:
盐的种类很多,有正盐、酸式盐、碱式盐、复盐、配合物盐、混盐等等。其中的混盐是由一种金属阳离子(包括NH4+)和两种酸根阴离子所组成的化合物。则下列物质属于混盐的是A.KAl(SO4)2•12H2OB.CaOCl2C.NaHSO4D.Mg2(OH)2CO3复盐、混盐、配合物盐(B)
形成配合物时性质的改变1、颜色的改变Fe3++nSCN-==[Fe(SCN)n](n-3)-2、溶解度的改变:AgCl+HCl=[AgCl2]-+H+AgCl+2NH3==[Ag(NH3)2]++Cl-Au+HNO3+4HCl==H[AuCl4]+NO+2H2O3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO+8H2O3、酸碱性的改变:[Cu(NH3)4](OH)2的碱性大于Cu(OH)2
三、杂化轨道理论简介二、价层电子对互斥理论(VSEPR模型)一、形形色色的分子第二节分子的立体结构四、配合物理论简介小结①分子的立体结构多种多样②红外光谱仪:测分子立体结构①无孤对电子分子的立体结构与VSEPR模型相同②有孤对电子分子立体结构为VSEPR模型去掉孤对电子占据位置后的立体结构①sp3杂化②sp2杂化③sp杂化①配位健——一种特殊的共价键②配位化合物,含配位键的复杂离子或分子③复盐、混盐、配合物盐
下列分子或离子中都存在着配位键的是A.NH3、H2OB.NH4+、H3O+C.N2、HClOD.[Cu(NH3)4]2+、PCI3(B)
下列各种说法中错误的是A、形成配位键的条件是一方有空轨道一方有孤对电子。B、配位键是一种特殊的共价键。C、配位化合物中的配体可以是分子也可以是阴离子。D、共价键的形成条件是成键原子必须有未成对电子。(D)
下列属于配合物的是()A、NH4ClB、Na2CO3﹒10H2OC、CuSO4﹒5H2OD、Co(NH3)6Cl3D
配合物K3[Fe(CN)6]中,中心离子的化合价是A.+3B.-3C.+6D.-6配合物[Zn(NH3)4]Cl2的中心离子的配位数是A.2B.3C.4D.5(A)(C)
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀。此氯化铬最可能是A.[Cr(H2O)6]Cl3B.[Cr(H2O)5Cl]Cl2·H2OC.[Cr(H2O)4Cl2]Cl·2H2OD.[Cr(H2O)3Cl3]·3H2O(B)
已知[Co(NH3)6]3+呈正八面体结构:各NH3分子间距相等,Co3+位于正八面的中心。若其中二个NH3分子被Cl-取代,所形成的[Co(NH3)4Cl2]+的同分异构体的种数有A.2种B.3种C.4种D.5种(A)
若将NH3看成是一个整体,[Ag(NH3)2]+的构型为直线型,中心原子Ag+的杂化轨道类型是A.spB.Sp2C.sp3D.dsp3A
如图是卟啉配合物叶绿素的结构示意图(部分),有关的叙述正确的是A.该叶绿素含有H、Mg、C、N元素B.该叶绿素是配合物,中心离子是镁离子C.该叶绿素是配合物,其配体是N元素D.该叶绿素不是配合物,而是高分子化合物B
Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。(1)若在第一种配合物的溶液中加BaCl2溶液时,产生现象;(2)如果在第二种配合物的溶液中加入BaCl2溶液时,产生现象,(3)若在第二种配合物的溶液中加入AgNO3溶液时,产生现象。白色沉淀无明显现象浅黄色沉淀
把CoCl2溶解于水后加氨水,直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使之生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种配合物其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。通过计算,确定此配合物的化学式。[Co(NH3)5Cl]Cl2
教学目标1、认识共价分子的多样性和复杂性;2、初步认识价层电子对互斥模型;3、能用VSEPR模型预测简单分子或离子的立体结构;4、培养学生严谨认真的科学态度和空间想象能力。5、认识杂化轨道理论的要点6、进一步了解有机化合物中碳的成键特征7、能根据杂化轨道理论判断简单分子或离子的构型8、配位键、配位化合物的概念9、配位键、配位化合物的表示方法10、采用图表、比较、讨论、归纳、综合的方法进行教学
教学重点:分子的立体结构;利用价层电子对互斥模型预测分子的立体结构;杂化轨道理论的要点;配位键、配位化合物的概念教学难点:分子的立体结构,杂化轨道理论;配位键、配位化合物的概念
4、教学必须从学习者已有的经验开始。——杜威5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基11、学会学习的人,是非常幸福的人。——米南德12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰15、学习是劳动,是充满思想的劳动。——乌申斯基16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东18、只要愿意学习,就一定能够学会。——列宁19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰20、对所学知识内容的兴趣可能成为学习动机。——赞科夫21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。53、希望是厄运的忠实的姐妹。54、辛勤的蜜蜂永没有时间悲哀。55、领导的速度决定团队的效率。56、成功与不成功之间有时距离很短只要后者再向前几步。57、任何的限制,都是从自己的内心开始的。58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。59、不要说你不会做!你是个人你就会做!60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。64、每一个发奋努力的背后,必有加倍的赏赐。65、再冷的石头,坐上三年也会暖。66、淡了,散了,累了,原来的那个你呢?67、我们的目的是什么?是胜利!不惜一切代价争取胜利!68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。70、平凡的脚步也可以走完伟大的行程。71、胜利,是属于最坚韧的人。72、因害怕失败而不敢放手一搏,永远不会成功。73、只要路是对的,就不怕路远。74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。24、凡事要三思,但比三思更重要的是三思而行。25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。26、没有退路的时候,正是潜力发挥最大的时候。27、没有糟糕的事情,只有糟糕的心情。28、不为外撼,不以物移,而后可以任天下之大事。29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。30、不屈不挠的奋斗是取得胜利的唯一道路。31、生活中若没有朋友,就像生活中没有阳光一样。32、任何业绩的质变,都来自于量变的积累。33、空想会想出很多绝妙的主意,但却办不成任何事情。34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。'
您可能关注的文档
- 化学反应中的能量变化4 鲁科版(课件PPT).ppt
- 化学反应中的能量变化0(课件PPT).ppt
- 化学反应中的热效应1(课件PPT).ppt
- 化学反应中的热效应0(课件PPT).ppt
- 化学反应与能量的变化5(课件PPT).ppt
- 化学反应与能量的变化2(课件PPT).ppt
- 化学反应与能量变化3(课件PPT).ppt
- 化学反应与能量6(课件PPT).ppt
- 化学与资源开发利用(课件PPT).ppt
- 几种重要的金属1(课件PPT).ppt
- 共价键的类型(课件PPT).ppt
- 从海水中获得的化学物质61(课件PPT).ppt
- 人教新课标品德与生活二年级下册《我和动物交朋友》课件PPT版.ppt
- 《期中必修1复习2》课件PPT(人教版必修1).ppt
- 《小露珠》课件PPT件.ppt
- 《土木工程材料》课件PPT第8章 沥青与沥青混合料.ppt
- 《土木工程材料》课件PPT第5章 建筑砂浆.ppt
- 数学分析课件PPT之十三章函数列与函数项级数.ppt