- 3.72 MB
- 2022-04-29 14:40:53 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'(超级整合)上课实用鲁科必修1第二章《元素与物质世界》复习课件
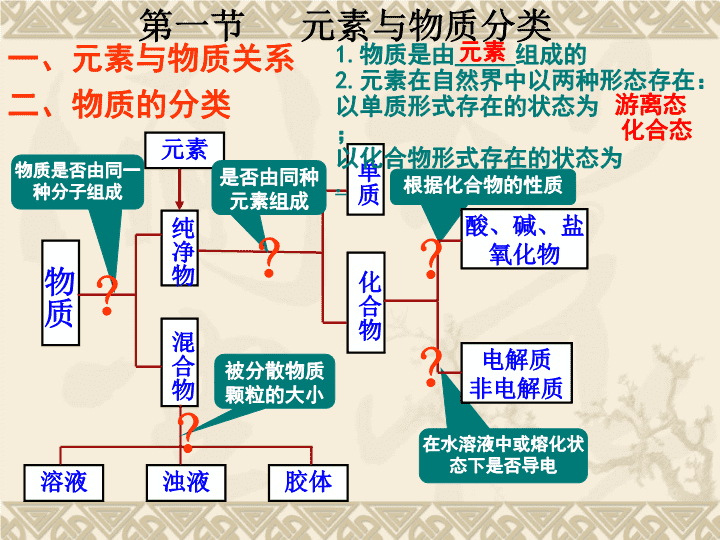
根据化合物的性质在水溶液中或熔化状态下是否导电二、物质的分类物质是否由同一种分子组成物质纯净物混合物单质化合物酸、碱、盐氧化物电解质非电解质溶液浊液胶体元素是否由同种元素组成被分散物质颗粒的大小?????第一节元素与物质分类1.物质是由_____组成的2.元素在自然界中以两种形态存在:以单质形式存在的状态为;以化合物形式存在的状态为.游离态化合态元素一、元素与物质关系
物质3.物质按组成分类:纯净物混合物单质化合物金属单质:FeCuMg非金属单质:CSP稀有气体:HeNeAr酸:碱:盐:氧化物:CO2SO2CuOFe2O3Na2OCaOHClH2SO4HNO3H2CO3HClONaOHCa(OH)2KOHBa(OH)2NaClCaCO3NH4Cl正盐酸式盐碱式盐NaHCO3Cu2(OH)2CO3结论:大多数非金属氧化物属于酸性氧化物,大多数金属氧化物属于碱性氧化物。能与____反应生成盐和水的氧化物,叫酸性氧化物能与____反应生成盐和水的氧化物,叫碱性氧化物碱酸酸性氧化物碱性氧化物第一节元素与物质分类
1.丁达尔现象——胶体的三大性质2.聚沉能使胶体聚沉的方法:加热、搅拌、加入某些盐、加入带相反电荷的胶体与胶体聚沉有关:制豆腐、三角洲的形成,两种不同的墨水混合使用造成钢笔堵塞3.电泳胶体微粒在外电场的作用下发生定向移动的现象第一节元素与物质分类三、胶体当可见光束通过胶体时,在入射光侧面可观察到光亮的通路。分散质聚集成较大的微粒,在重力作用下形成沉淀析出区别溶液和胶体
分散系分散系分散质微粒的大小外观特征能否透过滤纸能否透过半透膜有无丁达尔现象举例溶液胶体浊液第一节元素与物质分类
分散系分散系分散质微粒的大小外观特征能否透过滤纸能否透过半透膜有无丁达尔现象举例溶液小于1nm均匀透明能能无食盐水胶体1nm~100nm均匀透明或半透明能不能有蛋清豆浆Fe(OH)3胶体浊液大于100nm浑浊不均匀不透明不能不能无泥水第一节元素与物质分类
1.下列关于胶体的叙述不正确的是()A.利用电泳现象可以区别溶液和胶体B.胶体都可以发生丁达尔现象C.胶体粒子的大小都在1nm-100nm之间D.氢氧化铁胶体在电场作用下向正极移动2.下列事实与胶体性质无关的是()A、向豆浆中加入盐卤做豆腐B、钢笔使用不同牌子的墨水堵塞C、一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路D、向石灰水中通入二氧化碳气体产生白色浑浊D第一节元素与物质分类AD
电解质:在水溶液里或熔融状态下能够导电的化合物非电解质:在上述两种情况下都不能导电的化合物第2节电解质常见电解质:酸、碱、盐、水;常见非电解质:酒精、蔗糖、SO2、CO2、NH3区分电解质和非电解质的三个条件:1.化合物2.在熔融状态下或者水溶液里能导电3.自身电离注意:1、单质和混合物(如溶液)既不是电解质也不是非电解质2、电解质可能为难溶,如:BaSO4、AgCl一、电解质及其电离
例:现有①熔融的KNO3②干冰③纯醋酸④铜⑤酒精⑥蔗糖⑦硫酸溶液以上物质能导电的是_______属于电解质的是_____属于非电解质的是_______①④⑦①③②⑤⑥※能导电的物质有三类:1、金属单质2、电解质溶液3、熔融状态下的离子化合物(熔融状态即液态)第2节电解质
知识点击强电解质:在水溶液中全部电离成离子的电解质弱电解质:在水溶液中只部分电离成离子的电解质包括强酸如强碱如大多数盐包括弱酸如弱碱如水HClH2SO4HNO3CH3COOHH2CO3HClONH3•H2ONaOHKOHBa(OH)2Ca(OH)2包括可溶性和不溶性的盐第2节电解质
例:下列物质中属于电解质的是;属于非电解质的是;属于弱电解质的是;能导电的是。①金属铜②固态NaCl③CO2④纯H2SO4⑤纯CH3COOH⑥酒精水溶液⑦KOH水溶液⑧熔融状态的KNO3⑨葡萄糖⑩BaSO4固体②④⑤⑧⑩③⑨①⑦⑧⑤第2节电解质
是非题:1)离子化合物只有溶于水时才能导电。()2)氯化钠溶液在电流作用下电离成钠离子和氯离子()3)将AgCl放在水中不导电,所以AgCl是非电解质。()4)氨气溶于水,溶液能导电,所以氨气是电解质。()5)硝酸钾固体不导电,因此硝酸钾是非电解质。()6)在电解质溶液中存在着自由移动的离子,通直流电后离子作定向移动。()第2节电解质
例:下列关于电解质、非电解质的说法正确的A、氯气溶于水得氯水,该溶液能导电,因此氯气是电解质B、CaCO3饱和溶液导电能力很弱,所以CaCO3是弱电解质C、HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质D、CO2的水溶液能导电,故CO2是电解质第2节电解质
第2节电解质2、电解质的电离溶解于水或受热熔化时,离解成能够自由移动的离子的过程称为电离。酸:碱:盐:电离时,生成的阳离子全部是H+的化合物称为酸。电离时,生成的阴离子全部是OH-的化合物称为碱。电离能生成的金属阳离子(或NH4+)和酸根阴离子的化合物称为酸。
第2节电解质2、电解质的电离电离方程式:用化学式和离子符号来表示物质电离的式子。电离方程式的书写:NaCl电离的电离方程式:NaCl=Na++Cl-阳离子阴离子化学式生成符号离子符号(代表水合离子)检查:②生成符号右边离子所带的电荷总数为0——电荷守恒①生成符号两边各元素的原子个数相等——原子守恒③强电解质用“等号”,弱电解质用“可逆号”④原子团不能分开写
写出KOH、Ba(OH)2、CuSO4、NaNO3、MgCl2、NH4NO3在水中的电离方程式。KOH=K++OH-Ba(OH)2=Ba2++2OH-CuSO4=Cu2++SO42-NaNO3=Na++NO3-MgCl2=Mg2++2Cl-NH4NO3=NH4++NO3-2、电解质的电离电离方程式的书写:第2节电解质
练习:已知在水溶液中NaHSO4=Na++H++SO42-据此判断NaHSO4属于哪类物质?Cu2(OH)2CO3呢?NaHSO4在水溶液中电离时虽然产生了H+,但是阳离子中还有Na+,不全部是H+,不符合酸的定义。它应该属于盐类。Cu2(OH)2CO3属于盐。拓展:NaHCO3在水溶液中电离NaHCO3=Na++HCO3-第2节电解质
二、化学反应的分类1、分类方法化合反应分解反应根据反应物和生成物的类别和反应前后物质种类的多少置换反应复分解反应离子反应化学反应根据反应中是否有离子参加分子反应氧化还原反应根据反应中是否有电子转移非氧化还原反应第2节电解质
(1)定义:有离子参加的一类反应。(2)发生条件(复分解类型):生成难溶物、生成难电离物、生成挥发性物质。(3)表示方法——离子方程式定义:用实际参加反应的离子的符号来表示离子反应的式子。写:写出正确的化学方程式拆:把易溶且易电离的物质(盐、强酸、强碱)拆写成离子形式,难溶于水的盐、水和弱酸弱碱的物质以及气体、单质、氧化物等仍用化学式表示删:删掉不参加反应(相同)的离子查:检查方程式两边原子个数和电荷数是否相等揭示了化学反应的实质不仅表示特定物质间的某个反应还表示同一类型的反应书写方法离子方程式特点第2节电解质二、电解质在水溶液中的反应——离子反应及方程式某些离子数目的变化
第2节电解质二、电解质在水溶液中的反应——离子反应及方程式
第2节电解质二、电解质在水溶液中的反应——离子反应及方程式
检查离子方程式是否正确,至少可以从以下几反面进行判断a.__________________________b.__________________________c.__________________________d.__________________________e.__________________________电荷守恒原子个数守恒是否能拆成离子是否满足客观反应是否在水溶液中进行第2节电解质
1、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑2、铜与稀盐酸反应:Cu+2H+=Cu2++H2↑离子方程式的常见错误3、铜片插入硝酸银溶液:Cu+Ag+=Cu2++Ag4、碳酸钙加入醋酸:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O5、氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-6、钠跟水反应:Na+2H2O=Na++2OH-+H2↑7、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓第2节电解质
第2节电解质二、电解质在水溶液中的反应——离子反应及方程式离子共存问题:若两种离子能反应,生成沉淀、气体或弱电解质,或发生氧化还原反应,从而是离子浓度明显减小,那么这两种离子就不能大量共存。
a、看清题目,找出隐蔽条件。如在强酸(H+)、强碱(OH-)溶液中、是否有颜色b、离子之间的反应能生成沉淀的不能共存;生成水等难电离的物质不能共存;生成气体的不能共存常见有色的离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)、MnO4-(紫红色)常见生成沉淀的离子对:Ca2+与CO32-;Ba2+与CO32-、SO42-;Mg2+与OH-;Al3+与OH-;Ag+与Cl-;Cu2+与OH-;Fe3+与OH-生成水的离子对:H+与OH-常见生成气体的离子对:NH4+与OH-;CO32-与H+;HCO3-与H+;第2节电解质
例:下列离子方程式正确的是( )A、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑B、氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2OC、铜片与氯化铁溶液反应:Cu+Fe3+=Cu2++Fe2+D、钠放入水中:Na+H2O=Na++OH-+H2↑B第2节电解质
1)下列离子方程式正确的是()A.碳酸钙与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑B.锌与盐酸反应:Zn+2H++2Cl-=Zn2++2Cl-+H2↑C.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓D.Cl2通入FeCl2溶液Cl2+Fe2+=2Cl-+Fe3+AC第2节电解质
2)下列离子方程式正确的是()A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2OB.钠与水反应:Na+2H2O=Na++2OH-+H2↑C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++AgD.大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2OD第2节电解质
3)下列离子方程式中正确的是()A.小苏打溶液与稀硫酸混合CO32-+2H+=CO2↑+H2OB.大理石溶液与醋酸CaCO3+2H+=Ca2++CO2↑+H2OC.硫酸亚铁溶液与过氧化氢溶液混合Fe2++2H2O2+4H+=Fe3++4H2OD.氨水与醋酸溶液反应NH3·H2O+CH3COOH=CH3COO-+NH4++H2OD第2节电解质
例:碱性溶液中一定可以大量共存的离子组是()A、Al3+Na+NO3-Cl-B、K+Na+Cl-NO3-C、K+Na+Cl-HCO3-D、K+NH4+SO42-NO3-B例:下列各组中的离子,能大量共存的是()A、K+、H+、Cl-、CO32-B、K+、Cu2+、SO42-、NO3-C、H+、Na+、OH-、Cl-D、Mg2+、Al3+、OH—、SO42-B第2节电解质
检验离子的存在一、待测液中Cl-的检验:取少许溶液,向溶液中滴加AgNO3溶液,产生白色沉淀,再滴加稀硝酸,白色沉淀不溶解说明溶液中有Cl-二、待测液中SO42-的检验:取少许溶液,先加HCl酸化,无明显现象后,再加BaCl2溶液,产生白色沉淀,说明溶液中有SO42-问:可以加HCl酸化的BaCl2或先加BaCl2再加稀盐酸吗?-第2节电解质
三、待测液中CO32-、HCO3-的检验:1、向待测液中加入稀盐酸,将产生的气体通入澄清石灰水,可使澄清石灰水变浑浊。2、另取待测液分别滴加入CaCl2或BaCl2,观察是否有沉淀产生。(能否加澄清的石灰水?)四、Ba2+、Ca2+、Cu2+、Fe3+、Fe2+、Mg2+、Al3+、Na+、K+等金属离子的检验NO3-、NH4+、SO32-、HSO3-、Br-、I-、S2-等非金属离子的检验第2节电解质
※请记住几个经典的问题?1、往某溶液中加入BaCl2溶液,有白色沉淀生成,加稀HNO3沉淀不溶,证明该溶液中一定有SO42-吗?2、往某溶液中加入稀盐酸,有无色无味的气体生成,且该气体能使澄清的石灰水变浑浊,证明该溶液中一定有CO32-吗?3、往某溶液中加入浓的NaOH且加热,有刺激性气味的气体生成,且该气体能湿润的石蕊试纸变蓝,证明该溶液中一定有NH4+吗?第2节电解质
有一包白色固体粉末,可能含有Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种按以下步骤进行实验:(1)将固体粉末溶于水得无色溶液和白色沉淀;(2)加入稀盐酸,沉淀部分溶解且有气泡产生。根据以上现象,判断这种混合物里,一定含有‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗;一定没有‗‗‗‗‗‗‗‗,可能含有‗‗‗‗‗‗‗‗‗。Na2SO4、CaCO3、BaCl2CuSO4KCl第2节电解质习题:
习题:用一种试剂除去下列各物质中的杂质(括号内为杂质)(1)O2(CO2)‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗(2)BaCl2(HCl)‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗(3)SO42-(CO32-)‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗‗NaOHBa(OH)2H2SO4第2节电解质
第3节氧化剂和还原剂一、氧化还原反应1.氧化还原反应的概念及其关系从得失氧的角度分析标出化合价+20+10从化合价的角度分析特征:判断是否氧化还原反应的依据从电子转移角度分析氧化反应:物质所含元素的原子或离子失去电子(偏离)的反应还原反应:物质所含元素的原子或离子得到电子(偏向)的反应实质:有电子转移(得失和偏移)的反应
下列反应不属于氧化还原反应的是:练习第3节氧化剂和还原剂
判断下列哪些为氧化还原反应并说明理由:练习第3节氧化剂和还原剂
②③④二、①——记忆技巧第3节氧化剂和还原剂
氧化剂+还原剂=氧化产物+还原产物得到e-化合价↓发生还原反应具氧化性失去e-化合价↑发生氧化反应具还原性二、——记忆技巧化合价升高→失e-→做还原剂→表现还原性→被氧化→发生氧化反应→生成氧化产物化合价降低→得e-→做氧化剂→表现氧化性→发生还原反应→被还原→生成还原产物牢牢记住!(新氧化剂)(新还原剂)第3节氧化剂和还原剂
二、+4-1+2-10MnO2Cl22NA第3节氧化剂和还原剂
1.下列叙述正确的是()A.元素的单质可由氧化或还原该元素的化合物来制得B.得电子越多的氧化剂,其氧化性就越强C.阳离子在反应中只能得到电子被还原,作氧化剂D.含有最高价元素的化合物一定具有强氧化性2.为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用()A.H2O2溶液B.KMnO4溶液C.氯水D.HNO3溶液第3节氧化剂和还原剂
4.下列类型的反应,一定发生电子转移的是()A.化合反应B.分解反应C.置换反应D.复分解反应3.有关氧化还原反应的下列叙述正确的是()四大基本反应类型与氧化还原反应的关系第3节氧化剂和还原剂
1.常见的氧化剂:(1)非金属单质:如、、Br2等;O2Cl2(2)含有高价态元素的化合物:如、、HClO等含有较高价态的含氧酸,以及、、、NaClO、K2Cr2O7等含有较高价态的盐;MnO2等。(3)某些金属性较弱的金属的高价态离子:如、Ag+、Cu2+等。(4)过氧化物:如、等;HNO3浓H2SO4KMnO4KClO3FeCl3Fe3+Na2O2H2O2第3节氧化剂和还原剂
2.常见的还原剂:(1)活泼的金属单质:如、、、等;KNa(2)非金属单质及其氢化物:如、、NH3、H2S等;(3)低价态阳离子和氧化物:如、、CO、SO2等。(4)非金属离子及低价态化合物:如、、等;MgAlCH2Fe2+Cu+S2-I-SO32-第3节氧化剂和还原剂
第3节氧化剂和还原剂
(1)双线桥法:(2)单线桥法:箭头由反应物中变价元素指向生成物中同一元素,要标出“得到”或“失去”及电子数目(得失电子数目相等)。——谁变谁第3节氧化剂和还原剂
(2)单线桥法:箭头是在反应物中由失电子的元素指向得电子的元素,只要标出得失电子数目(得失电子数目相等)。第3节氧化剂和还原剂
第3节氧化剂和还原剂
第3节氧化剂和还原剂
第3节氧化剂和还原剂
第3节氧化剂和还原剂
4.价性关系:若某元素有多种可变价态,处于最高价态时,只有氧化性;处于最低价态时,只有还原性;处于中间价态时,既有氧化性,又有还原性。既有氧化性,又有还原性的是:.Fe2+.Cl2.ClO-.S.SO2.H2S第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:一)根据方程式判断氧化还原性的强弱——强弱律(强氧化性)(强还原性)(弱还原性)(弱氧化性)氧化性:>;还原性:>;氧化剂氧化产物还原剂还原产物第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:一)根据方程式判断氧化还原性的强弱第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:一)根据方程式判断氧化还原性的强弱第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:二)根据金属和非金属活动顺序表或元素周期律判断同一周期从左至右(稀有气体除外)单质的还原性减弱,氧化性增强同一主族从上至下单质的还原性增强,氧化性减弱第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:二)根据金属和非金属活动顺序表或元素周期律判断第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:三)根据反应条件或反应的剧烈程度判断Li、Na、K等与水反应的剧烈程度——渐剧烈,判断还原性增强第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:四)根据产物的价态高低判断当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱。第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:五)根据电化学知识判断第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:六)根据其他因素判断还原性:浓HCl>稀HCl氧化性:热浓H2SO4>冷浓H2SO4第3节氧化剂和还原剂
5.氧化性和还原性强弱的判断:第3节氧化剂和还原剂
6.氧化还原反应的基本规律:4、第3节氧化剂和还原剂
6.氧化还原反应的基本规律:第3节氧化剂和还原剂
6.氧化还原反应的基本规律:第3节氧化剂和还原剂
7.氧化还原反应的配平:一)配平原则第3节氧化剂和还原剂
7.氧化还原反应的配平:二)配平步骤第3节氧化剂和还原剂
7.氧化还原反应的配平:二)配平步骤第3节氧化剂和还原剂
1.氧化剂、还原剂、氧化产物、还原产物的判断练习:在Mg+2HCl=MgCl2+H2↑中,______是氧化剂,________是还原剂,被氧化,被还原,氧化产物是,还原产物是_______HClMgMgHH2MgCl2第3节氧化剂和还原剂
已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是()A.2NaW+Z2=2NaZ+W2B.2NaX+Z2=2NaZ+X2C.2NaY+W2=2NaW+Y2D.2NaZ+X2=2NaX+Z2BC第3节氧化剂和还原剂2.氧化性、还原性强弱的判断
第3节氧化剂和还原剂
4、NO2被水吸收发生:3NO2+H2O=2HNO3+NO,反应中,发生还原反应和发生氧化反应的物质,其物质的量比()A、3:1B、1:3C、1:2D、2:1第3节氧化剂和还原剂
5.硫代硫酸钠(Na2S2O3)可作为脱氯剂,如Na2S2O3和氯气反应,可将氯气完全转化为CI-从而消除氯气对环境的污染,则在该反应中S2O32-不能转化为()A.S2-B.SO2C.SD.SO42-6.法医常用“马氏试砷法”来证明是否为砒霜(As2O3)中毒。方法是:用锌.盐酸与被检验试样混和,若有砒霜,则发生反应生成砷化氢、氯化锌。下列对这一反应的叙述中,正确的是()A.盐酸做氧化剂B.砒霜做氧化剂C.锌和盐酸做还原剂D.盐酸做还原剂,AC第3节氧化剂和还原剂
第3节氧化剂和还原剂
第3节氧化剂和还原剂
8、在Cu和稀硝酸的反应中,如果有3.2gCu参加反应,则被还原的硝酸的物质的量是_______解:3Cu~8HNO3~2HNO3320.05molx注:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2OX=0.033mol第3节氧化剂和还原剂
铁盐和亚铁盐的性质
Fe2+的还原性和氧化性①还原性:易被H2O2溶液、氯水、硝酸、KMnO4等氧化剂氧化Fe2+、Fe3+离子的氧化还原性Fe3+的氧化性易被铁粉、铜粉、Zn、KI等等还原剂还原,被还原为Fe2+.1.Fe的还原性:与Cl2、O2、H+、Cu2+、Fe3+等反应,表现了铁较活泼的化学性质。②氧化性:Fe2+可以被Zn还原
(1)Fe3+的检验方法:①观察溶液颜色:溶液为棕黄色③加SCN-:Fe3++3SCN-===Fe(SCN)3(红色溶液)1、铁盐和亚铁盐②加OH-:生成红褐色沉淀(2)Fe2+的检验方法:①观察溶液颜色:溶液为浅绿色②加OH-:生成白色沉淀迅速变灰绿色最后呈红褐色沉淀③加SCN-后无变化。能使酸性的高锰酸钾褪色,再加SCN-后溶液变红。
(2)Fe3+和Fe2+的转化Fe(OH)2加入现象反应的化学方程式FeCl3中加入铁粉和KSCN溶液上层清液中加氯水2FeCl3+Fe=3FeCl22FeCl2+Cl2=2FeCl32Fe3++Fe=3Fe2+2Fe2++Cl2=2Fe3++2Cl-溶液变红色黄色溶液变成浅绿色,加KSCN后溶液不变色总结Fe3+Fe2+Zn、Fe、Cu、I_等较强的还原剂Cl2、Br2、HNO3等较强的氧化剂三、铁的重要化合物
直接观察颜色与KSCN显色的氧化性利用与铜片与淀粉KI试纸鉴别方法浅绿色棕黄色红色不显红色无明显现象Cu被腐蚀溶液变蓝色试纸不变蓝试纸变蓝色白色沉淀迅速变灰绿色最后呈红褐色立即产生红褐色沉淀与NaOH溶液反应如何区分Fe2+和Fe3+Fe3+Fe2+三、铁的重要化合物
[小结]“铁三角”Fe0Fe+3Fe+2H+Cu2+Fe3+ZnH2COZnH2COCl2HNO3FeCuZnI-SO2Cl2HNO3H2O2KMnO4
【知识运用】1.为什么实验室在配制FeCl2或FeSO4溶液时,通常还要往溶液中加入铁钉或铁粉?答:防止Fe2+被氧化成Fe3+Fe+2Fe3+=3Fe2+三、铁的重要化合物
(1)下列叙述正确的是()A.含最高价元素的化合物,一定具有强的氧化性B.阳离子只有氧化性,阴离子只有还原性C.失电子多的还原剂,还原性就强D.在化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被还原(2)除去FeCl2溶液中的少量FeCl3,可加入____________;除去FeCl3溶液中的少量FeCl2,可加入___________,除去FeCl2溶液中的少量CuCl2,可加入__________。D铁粉氯水铁粉
1:有NaCl、FeCl3、FeCl2、MgCl2、AlCl3五种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是()A、盐酸B、烧碱溶液C、氨水D、KSCN溶液B三、铁的重要化合物练习
2:下列各组离子能大量共存于同一溶液的是()A.Fe3+NH4+Cl-H+B.Fe2+H+CO32-Cl-C.Fe3+OH-SO42-Cl-D.Fe2+Ca2+NO3-H+A三、铁的重要化合物
3、现榨的苹果汁在空气中会由绿色变为棕黄色,其原因可能是()A.苹果汁中的Fe2+变成Fe3+B.苹果汁含有Cu2+C.苹果汁含有OH-D.苹果汁含有Na+4、为了检验某FeCl2溶液是否变质,可以向溶液中加入()A、NaOH溶液B、铁片C、KSCN溶液D、石蕊试液AC三、铁的重要化合物
1、在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )A、Fe2+B、Fe3+和Fe2+C、Cu2+和Fe2+D、Cu2+练一练:A2、向某溶液中滴加KSCN的溶液,无明显现象,再向其中滴加氯水,溶液变为血红色,则下列说法正确的是( )A、原溶液中一定含有Fe3+离子,不含Fe2+B、原溶液中一定含有Fe2+离子,不含Fe3+C、溶液中的Fe2+离子被氯气还原为Fe3+D、溶液中同时含Fe2+或Fe3+离子B
(3)已知铜在常温下能被HNO3溶解。反应方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O1)请将上述反应改成离子方程式_________________________________,2)上述反应中,氧化剂是_________,氧化产物是__________。HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的_____。Cu(NO3)23Cu+8H++2NO3-=3Cu2++2NO↑+4H2OHNO33/4
4、已知A、B为气体单质,其中一种为黄绿色;D为常见金属单质,C为化合物,它们之间有下列转化关系:AB点燃CH2OC的水溶液DE溶液AFBED(1)试写出A、B、C、D的化学式:A;B;C;D。(2)写出C的水溶液与D反应的离子反应方程式:。(3)F与D反应的离子反应方程式:。(4)检验F中阳离子的试剂可以用:,现象:。
第四十一章氨基糖苷类抗生素吴宜艳
氨基苷类抗生素aminoglycosides含氨基醇环与氨基糖分子,并由配糖键连接成苷而得名1来自链霉菌链霉素、新霉素、卡那霉素、妥布霉素、大观霉素2来自小单孢菌庆大霉素、西索米星、小诺米星3人工半合成阿米卡星、奈替米星
主要优点抗需氧G(-)杆菌活性强PAE明显主要缺点无抗厌氧菌活性消化道不吸收损伤肾功能和第八对脑神经
一.氨基苷类抗生素的共性1.化学结构基本相似,碱性,易溶于水,
性稳定
2.抗菌谱极相似:主要对革兰氏阴
性菌有强抗菌活性,在碱性中作用增
强,静止期杀菌强
3抗菌作用机制相同抑制蛋白质合成的多个环节1.抑制核糖体70S亚基始动复合物的形成2.选择性地与核糖体30S亚基上的靶蛋白结合,造成A位歪曲,使mRNA密码错译3.阻止肽链释放因子R进入A位,使已合成的肽链不能释放4.阻止70S解离,造成细菌体内核糖体耗竭,循环受阻破坏细菌细胞膜,增加其通透性
氨基苷类氨基苷类氨基苷类四环素类大环内酯类氯霉素类林可霉素类抑制细菌蛋白质︱合成︱
4.体内过程基本相似:口服难吸收,在
肠内成高浓度;肌注或皮下注射给药
吸收迅速;主要分布于细胞外液;在
肾皮质及内耳外淋液浓度较高,体内
不被代谢,大部分以原形从肾泄.
5.易产生抗药性,可产生完全或部分交
叉药性,产生机制是由于细菌产生钝
化酶
(1)单向交叉耐药性:链霉素庆大、卡那
(2)双向交叉耐药性:庆大卡那
(1)耳毒性a.前庭功能损害:眩晕、恶心、呕吐、眼球震颤奈替米星<庆大<链霉素b.耳蜗神经损害:耳鸣、听力减退或耳聋损害内耳柯蒂器内、外毛细胞的糖代谢和能量利用,导致Na+-K+ATP功能障碍链霉素<妥布<奈替米星<庆大C.避免与耳毒性和抗组胺药合用耳毒性药物:万古霉素、高效利尿药、顺铂抗组胺药:苯海拉明、美克洛嗪、布可立嗪6主要不良反应:耳毒性、肾毒性、神
经肌肉阻断及过敏反应:
机理:
内耳淋巴液中药物浓度过高,损害内耳柯氏器内、外毛细胞的糖代谢和能量利用,导致内耳毛细胞的细胞膜钾钠离子泵障碍,使毛细胞功能受损
预防:
因“亚临床耳毒性”发生率高达10-20%,故在早期耳鸣、眩晕时进行听力监测,并依肾肌酐清除率及血浓度调节剂量。
(2)肾毒性亲和力高近曲小管上皮细胞轻:肾小管肿胀重:蛋白尿、管型尿、血尿药物吞饮肾皮质、髓质细胞溶酶体线粒体Ca2+细胞肿胀、坏死积聚溶酶体肾细胞损伤机制:链霉素<奈替<阿米<妥布<庆大强效利尿药第一代头孢万古霉素顺铂
(3)神经肌肉接头阻滞大剂量腹膜或胸膜(A)与剂量及给药途径有关(B)静注快,合用肌松剂、全麻药时明显心肌抑制、血压下降、呼吸衰竭与突触前膜Ca2+部位结合,阻止Ach释放,抢救:新斯的明和葡萄糖酸钙(4)过敏反应血管神经性水肿、皮疹、发热新霉素接触性皮炎链霉素严重的过敏性休克,必须皮试
链霉素临床应用抗G(-)和铜菌最小1.鼠疫与土拉菌病的首选药+四环素2.+青霉素或氨苄西林心内膜炎3.+其他抗结核药多重耐药结核病不良反应1.耳毒性:前庭损害2.过敏反应:过敏性休克现用现配肾毒性最小3.神经肌肉接头阻滞二.各种氨基苷类药理特点及应用
庆大霉素临床应用1.多种G(-)杆菌感染首选药沙雷菌属2.+羧苄西林铜绿假单孢菌感染,不可混滴3.+羧苄西林、头孢菌素:未明原因的G(-)杆菌混合感染4.口服:术前预防和术后感染不良反应1.耳毒性:前庭损害2.肾毒性:较多见,多尿、蛋白尿3.神经肌肉接头阻滞过敏性休克偶见
妥布霉素(tobramycin)对铜绿假单孢菌作用>庆大霉素2-5倍,对庆大霉素耐药者仍有效+青霉素类或头孢菌素(抗铜菌者):治疗铜绿假单孢菌的各类感染,如感染性心内膜炎不良反应<庆大霉素
阿米卡星抗菌谱:最广,G(-)+金葡菌优点:1.对钝化酶稳定肠道G(-)和铜绿菌首选药:其他氨基苷类耐药菌株引起的感染2.与内酰胺合用协同作用+羧苄西林或头孢噻吩:粒细胞减少或其他免疫缺陷者感染耳毒性>庆大肾毒性<庆大卡那霉素+其他抗结核药对一线耐药的结核杆菌患者肝昏迷或腹部术前准备
总结1掌握氨基苷类抗生素的共性。
2掌握各种氨基苷类抗生素的药理特点及应用。
思考题
1试述氨基苷类抗生素的抗菌机制及不良反应。
2试述庆大霉素及阿米卡星的抗菌作用特点及临床用途。'
您可能关注的文档
- 最新(精品文档)新课标人教版五年级数学上册总复习课件(全册)PPT演示课件课件PPT.ppt
- 最新(耳鼻咽喉头颈外科学)3.2耳鼻喉科学·慢性扁桃体炎课件PPT.ppt
- 最新(纲目版)第2章 区域经济学的基础概念课件PPT.ppt
- 最新(语文S版)一年级语文上册课件-聪明的小白兔(一)课件PPT.ppt
- 最新(苏)教版新教材三年级下册小数的初步认识-的ppt课件PPT.ppt
- 最新(语文版)九年级上册沁园春雪上课课件课件PPT.ppt
- 最新(课堂教学课件1)金木水火土课件PPT.ppt
- 最新(课件2)6.1平面直角坐标系课件PPT.ppt
- 最新(轻金属冶金学1-2)镁冶金学第二讲----热还原法的原理与过程课件课件PPT课件.ppt
- 最新(赛课课件)部编版11赵州桥课件PPT课件.ppt
- 最新(课题)前滚翻课件课件PPT.ppt
- 最新(课堂教学课件3)老人与海鸥课件PPT.ppt
- 最新(青岛版)四年级科学下册课件-玩镜子-1课件PPT.ppt
- 最新(陕旅版)四年级英语下册课件-Unit1-Our-New-House-(1)课件PPT.ppt
- 最新(重点)四川大学等高校机械考研资料点习题答案课件PPT.ppt
- 最新-4.3.1--角(新人教版)课件PPT.ppt
- 最新-声音的产生与传播课件1课件PPT.ppt
- 最新-圆的面积(例1)(1)ppt课件PPT.ppt