- 959.00 KB
- 2022-04-29 14:42:56 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第19章--金属通论
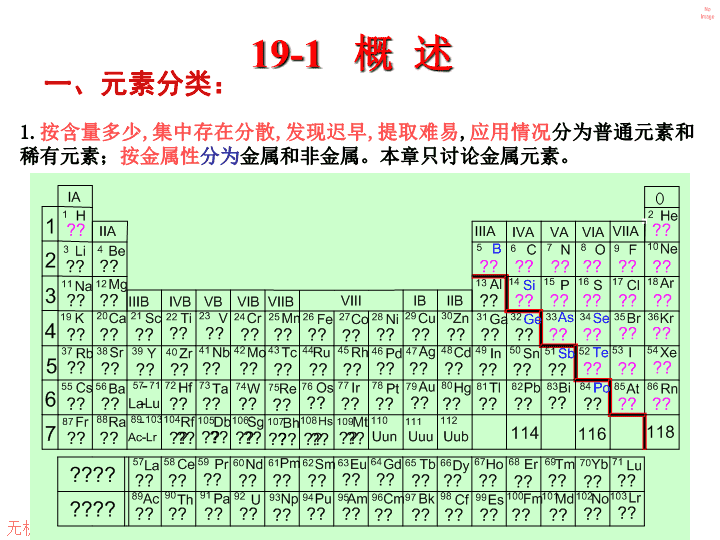
无机化学19-1概述一、元素分类:1.按含量多少,集中存在分散,发现迟早,提取难易,应用情况分为普通元素和稀有元素;按金属性分为金属和非金属。本章只讨论金属元素。
一、金属元素特征:1.χ<2.0;2.价层电子数少,在化学反应中易失电子。二、位置s,d,ds,f及p区左下.
五、存在形式1.不活泼的Au、Ag、Pt等以游离态形式存在;2.游离态及化合态:较活泼金属:如铁,有单质、氧化物3.活泼的以化合态:(1)卤化物:ⅠA.ⅡA,海水里较多(2)难溶盐矿石:ⅡA的CO32-、、PO43-、SO42-、硅铝酸盐(3)氧化物及硫化物:过渡金属海水中含大量金属(80多种元素、60多种金属)U10亿吨 Au500万;
氧化物形态:磁铁矿(Fe3O4)软锰矿(MnO2)赤铜矿(Cu2O)矾土矿(Al2O3·XH2O)硫化物形态:闪锌矿(ZnS)方铅矿(PbS)辉铜矿(CuS2)闪银矿(Ag2S)卤化物形态:NaCl,CaF2,光卤石(MgCl2·KCl·6H2O)含氧酸盐菱镁矿MgCO3方解石CaCO3硫酸盐重晶石BaSO4石膏CaSO4·2H2O硝酸盐钠硝石NaNO3磷酸盐磷灰石[Ca5F(PO4)3]硅酸盐绿柱石(3BeO·Al2O3·6SiO2)矿石俗名
工业上能用来提炼金属的矿物称为矿石。绝大多数矿石都多少含有杂质。主要是石英、石灰石和长石等,这些物质也称为脉石。所以从矿石中提炼金属一般经过三大步骤:(1)矿石的富集(采矿、选矿),(2)冶炼,(3)精炼一.矿石的富集就是预先处理矿石,把其中所含大量脉石移去,以提高矿石中有用成分的含量。选矿的方法:根据矿石的颜色、光泽、形状等不同的特征可进行简单的手选,利用矿石中有用成分与脉石的密度、磁性、粘度、熔点等性质的不同,可以采用不同的方法选矿,常用的选矿法有水选法、磁选法和浮选法等。19-2金属的提炼
无机化学二、冶炼根据金属化学活泼性不同,采取不同的冶炼方法冶炼的方法有:湿,干法(火法)1、热分解法氢后面的金属例2Ag2O△Ag+O2↑2HgO△2Hg+O2将辰砂(硫化汞)加热也可以得到汞:HgS+O2==Hg+SO2
2、热还原法根据金属活泼性,选择合适的还原剂①用焦碳作还原剂ZnO+C→Zn+COSnO2+2C===Sn+2CO2MgO+C==Mg+CO反应若需要高温,常在高炉和电炉中进行。所以这种冶炼金属的方法又称为火法冶金氧化矿、碳酸盐(因为一般重金属的碳酸盐受热时都能分解为氧化物)、硫化矿都可用此法。2PbS+3O2===2PbO+2SO2PbO+C===Pb+CO优点:还原剂价廉易得。缺点:易造成合金 含碳量高
②用氢气作还原剂:制取不含碳的金属和某些稀有金属一般H2还原生成热较小的氧化物,例如,氧化铜、氧化铁等,容易被氢还原成金属。而具很大生成热的氧化物,例如,氧化铝、氧化镁等,基本上不能被氢还原成金属。用高纯氢和纯的金属氧化物为原料,可以制得很纯的金属。例:WO3+3H2=W+3H2O有
③用比较活泼的金属作还原剂例:Cr2O3+2A1→2Cr+A1203TiC14+2Mg→Ti+2MgC12注意选择标准:a.还原力强b.容易处理c.不与产品金属形成合金d.可以得到高纯度金属 e.其它产物易和生成金属分离f.成本低通常用的是 Al、Ca、Mg、Na等Al最常用
铝容易和许多金属生成合金。可采用调节反应物配比来尽量使铝完全反应而不残留在生成的金属中。钙、镁一般不和各种金属生成合金,因此可用作钛、锆、铪、钒、铌、钽等氧化物的还原剂。有些金属氧化物很稳定,金属难被还原出来,可以用活泼金属还原金属卤化物来制备,如:TiCl4+4Na===Ti+4NaClTiCl4+2Mg===Ti+2MgCl2铝是最常用的还原剂即铝热法
4、淘金法例:Au、Ag以密度不同而分离5、湿法冶金对于稀土 络合萃取 使之富集,离子交换 其他:例U3、电解法较活泼的Al前面的金属适宜用此法例:NaC1电解Na+1/2C12KCaNaMgAl电解是最强的氧化还原手段.优点:产品纯 易进行;缺点:耗电量大,成本高。一种金属采用什么提炼方法与它们的化学性质、矿石的类型和经济效果等有关。
三、金属还原过程的热力学从热力学的角度,应用自由能变△Gθ可以判断某一金属从其化合物中还原出来的难易,以及如何选择还原剂等问题。金属氧化物越稳定,则还原成金属就越困难。各种不同金属氧化物还原的难易可定量地比较他们的生成自由能来确定。氧化物的生成自由能越负,则氧化物越稳定,金属亦就越难被还原。
Ellingham(艾林罕姆)在1944年首先将氧化物的标准生成自由能对温度作图(以后又对硫化物、氯化物、氟化物等作类似的图形),用以帮助人们:①判断哪种氧化物更稳定②比较还原剂的强弱③估计还原反应进行的温度条件④选择还原方法,选择合适的还原剂以消耗1molO2生成氧化物的过程的自由能变作为标准来进行比较
由于ΔG=ΔH-TΔSΔH、ΔS随T变化不大,假定ΔH、ΔS为定值,则ΔG对个作图便可得到一条直线,P637图就为氧化物的自由能图,图中ΔH是截距,ΔS为斜率,此图是1944年Ellingham第一次将此作出,∴亦称Ellingham图。也称自由能—温度图。这种图在冶金学上具有特别重要的意义。
从图中可以看出:a、大多数几乎是平行的关系,所以斜率ΔS相差不大.ΔS<0,斜率正值,ΔG随温度升高而增大,大多数ΔS>0,斜率负值,ΔG随温度升高而减小,C→COΔS=0,ΔG与温度无关,CO2b、有些线有一拐点(相变点),说明在某一温度时,熵开始变化。(如熔化、气化、相转变等,必将引起熵的改变,此时直线的斜率发生变化)Ca、Mg的熔化
思考:1.对大多数金属氧化物的生成来说,为何有正的斜率?答:如2M+O2=2MO,由于消耗氧气的反应是熵减少的反应,因而直线有正的斜率2.对2C+O2=2CO,为何有负的斜率?答:因此反应是气体分子数增加,是熵增的反应,因而直线有负的斜率3.线上的拐点,说明什么?答:有些线有一拐点(相变点),说明在某一温度时,熵开始变化
1、在ΔfGӨ负值区内的所有金属都能自动被氧氧化,凡是在这个区域以上的金属则不能。由图可知约在773K以上Hg就不被氧所氧化,而HgO只需稍微加热,超过773K就可以分解得到金属。从图中可以得出如下结论:金属角度
2、氧化物的稳定性和其ΔrGӨ值大小直接有关稳定性差的氧化物ΔrGӨ负值小,ΔrGӨ-T直线位于图上方,例如HgO。稳定性高的氧化物ΔrGӨ负值大,ΔrGӨ-T直线位于图下方如MgO。根据图上各种线的位置的高低就可判断出这些氧化物稳定性的相对大小.显然金属-氧化物的线位置越低,氧化物越稳定。氧化物角度
3.图中C+O2=CO2的ΔrSӨ≈0,反应2C+O2=2CO的ΔrSӨ>0;反应2CO+O2=2CO2的ΔrSӨ<0。三条直线交于983K。高于此温度,2C+O2=2CO的反应倾向大,低于此温度,2CO+O2=2CO2的反应倾向更大。生成CO的直线向下倾斜,这使得几乎所有金属的ΔrGӨ-T直线在高温下都能与C-CO直线相交。能够被碳还原,碳为一种广泛应用的优良的还原剂983K
如:C+Al2O3反应温度范围:T<2100K时,C-CO线位于Al-Al2O3线之上,表明Al2O3的生成自由能比CO要负,C不能用作Al2O3的还原剂。但T<2100K时,CO的生成自由能比Al2O3的要负,即C能从Al2O3中夺取氧而使Al2O3还原。
再如:C还原SiO2的温度范围。在低温,如273K时,CO的生成自由能大于SiO2的生成自由能,所以在此温度下,C不能还原SiO2;但当温度约在1673K时两线相交,超过此温度时CO的生成自由能低于SiO2的生成自由能,故在T>1673K时,C还原SiO2的还原反应可以发生。
③如若一个还原反应能够发生,必须是艾林罕姆图上位于下面的金属与位于上面的金属氧化物之间相互作用的结果。反之,位于上面的金属与位于下面的金属氧化物之间的反应将不发生。这表明位于下面的金属还原性强。根据这个原则,从艾林罕姆图可以排列出常见还原剂在1073K的相对强弱次序:Ca>Mg>A1>Ti>Si>Mn>Na……同理,常见氧化剂在1073K的强弱次序:HgO>Ag2O>Fe2O3>Cu2O>NiO>Fe3O4>CoO
无机化学根据艾林罕姆图可以选择金属氧化物还原方法,亦即在本章开始时介绍的金属提取的一般方法的依据。①氧化物热分解法位于艾林罕姆图上端的Ag-Ag2O和Hg-HgO线,在273K时位于△Gθ=0线的下方,即在273K时,这些氧化物的标准生成自由能是负值。但温度升高,如升到673K以上,这时两条线均越过△Gθ=0的线,即在673K时,△Gθ>0。这一变化意味着Ag2O、HgO在温度升高时会自动分解。所以对这些不活泼的金属氧化物就可以采用氧化物的热分解法来获得金属。
无机化学②C还原法在较低温度时由C生成CO的标准生成自由能不是太负,但由于C-CO线是负斜率(且斜率负值较大)线,因而增加了与金属-氧化物线相交的可能性,即很多金属氧化物都可在高温下被C还原,这在冶金上有十分重要的意义。以C为还原剂,在低于1000K产物是CO2,高于1000K生成物则为CO。CO也是一种还原剂(CO→CO2),由艾林罕姆图可见,与C相比,在大约1000K以下CO还原能力比C强,大于1000K则是C的还原能力比CO强。因为在1000K以上,C的线已位于CO线之下。③活泼金属还原法位于艾林罕姆图中下方的金属氧化物具有很低的标准生成自由能,这些金属可从上方的氧化物中将金属还原出来,常用的金属还原剂有Mg、Al、Na、Ca等
④氢还原法在艾林罕姆图中H2-H2O线(左图中的红线)的位置较高,由H2生成H2O的△Gθ不太负,位于H2-H2O线上方的M-MO线也不是很多,由于△Gθ比H2O低的氧化物显然用H2不能将其还原,而且,H2-H2O线斜率为正,与M-MO的线相交的可能性也不大。说明H2并不是一个好的还原剂。只有少数几种氧化物如Cu2O、CoO、NiO等可被H2还原。
⑤电解还原法在艾林罕姆图下方的金属氧化物有很低的标准生成自由能值,这些金属氧化物的还原必须通过电解的方法才能实现。如Na、Mg、Al、Ca等都是通过电解来制取的。
无机化学四、金属的精炼1、电解2、气相精炼法3、区域熔炼法
无机化学19-3金属的物理和化学性质金属的物理性质金属与非金属性质有明显的差别:p641表19—2一、金属光泽:紧堆密结构:自由电子吸收可见光再全反射形成。大多为金属特有的金属光泽。个别特殊:Au黄色Cu:赤红色Bi:淡红色Cs淡黄色Pb灰蓝色晶体中外层d电子能吸收蓝紫色的短波长的光光电效应:光照射放出电子热电现象:加热高温放出电子影响因素:温度、密度、表面光洁程度半导体金属 大多为灰色。
无机化学二、导电性、导热性原因:金属导电 主要是有自由电子类型:一般认为:如果把金属的导电全部看成是自由电子在电场中定向移动的结果,是不符合事实的。因为①:如果自由电子完全参与导电,价电子越多,导电率应该越高。那么过渡金属导电性应最好,但实际为Ag、Cu、Au、Al。过渡金属导电率较弱。②电子在电场作用下定向加速,如果没有什么力量阻止这种加速趋势,根据热力学定律,金属电阻应为零。但实际是晶体中离子干扰、碰撞。纯金属的导电性较好,温度上升离子振动加快,排到有序度减小。∴金属的导电性受参加导电的电子数和产生电阻的两个因素影响。
在相同温度下,K、Na等低熔点的金属晶格能小,离子振动程度强,而过渡金属的熔点高晶格能大、离子振动程度弱,但是其价电子容易移入空的d能级中去,不再参与导电。∴总的来说,两者导电程度差不多。在25℃时常见金属的导电率为:导热性同导电性超导性:临界温度p642AgCuAuAlMgNaZnNiKCoFe66.764.54940252318.1165.91511.2电导率/Ω·cm-1×104
三、金属的延展性延性:PtAuAgAlCuFeNiZnSnPo展性:AuAgAlCuSnPtPbZnFeNi金属晶体的滑移层一般是最密排列层,因为最密层的层内原子联系紧密,容易形成一个整体运动.面心立方晶体的金属(Ag、Au、Cu、Al和高温下的Fe),延展性都比较好,这是因为与立方体4个对角线轴垂直的面都是密排面,其密排面最多,六方密堆积(Zn、Mg、Be、Cd等)、体心立方都次之(Ca、Ti、Cr、W常温下Fe).Sb、Bi晶体内原子间有共价键,∴没有延展性。延性与展性不是一个概念,从结构角度来分析,延展性是固体内各结构微粒构成的层与相邻的层发生相对位移时,不破坏微粒间的价键,而保持微粒间的结合作用。分子晶体、离子晶体、原子晶体都不行,只有金属晶体行。常具金属的延展性顺序为:
无机化学四、金属的熔点与沸点最难熔的是钨:W3883KRe3450KOs3270KMo2880K最易熔的是汞:铯(301.4K)镓(302.9K)在金属晶体中,依靠自由电子对于金属离子的吸引力把金属原子堆积在一起。金属熔化时各金属原子间的金属键没有被破坏,只是原子间的距离略有增大(指典型金属),原子可以远距离相对移动而已,液态金属变为气态时,金属键完全被破坏,分离成单个原子(碱金属中有少量M2分子),因此金属的蒸发热一般比熔化热大得多,往往相差几十倍,例如Na熔化热2.6kJ·mol-1、蒸发热98kJ·mol-1,∴金属的熔点比沸点低的多。目前还没有解释mp、bp成熟的理论。但可以肯定金属晶体内自由电子数目增多,其熔点,沸点升高.
无机化学d区元素有较多可用于成键的价电子(d电子)而熔点高,而S、P区金属电子构型与d区元素不同,无d电子,故较铬、铁等熔点低。ds区金属由于它们的d10构型稳定,参加成键的电子数较少,故熔点也低,尤其Zn、Cd、Hg∴低熔金属集中在ⅡB、P区。同样,d区的Mn、Tc、Re相对于其他d区的元素的熔点较低,也是因为d5构型较稳定所议。同族S、P区金属元素自上主下熔点升高故高熔点金属W、Re等集中第三过渡系。由于S、P区金属元素,当原子序数增大时,价层轮道增加较集中在核心附近,因此,S、P轨道重叠下降,尤其6P金属中,6S电子非常集中在核心附近,故对金属键无贡献,即金属原子间结合力下降,故熔点下降。
五、金属的密度六、金属的硬度(莫氏硬度10个等级)最硬的为Cr(硬度为9)七、金属的内聚力定义:物质内部质点间的相互作用力。对于金属,就是金属键的强度。用它的升华热衡量。升华热(原子化热)是指单位物质的量的金属由结晶态转变为自由原子所需的能量。也就是拆散金属晶格所需的能量。显然金属键越强内聚力越大,升华热就愈高。P654溶解:普通溶解中不溶,可以溶解于汞中。最重的为:锇Os(22.7)Ir(22.6)Pt(19.32)W(19.10)Au(18.88)最轻的为Li(0.534)
无机化学金属的化学性质金属最主要的共同性质都易失去最外层的电子变成金属离子,因而表现出较强的还原性。M-ne→Mn+(n=1、2、3)各种金属原子失去电子的难易程度很不相同,∴还原能力亦不同。气态时 用电离能衡量 Ⅰ水溶液中,用标准电极电势衡量ФӨP643表19-3原因:从结构上找:①半径r大,核对外层吸力弱;②构型③有效核电荷(离子势)④外层电子数较少 过渡金属易失去d电子
无机化学一、金属与非金属的反应O2(空气)分为三种情况:①在空气中迅速反应,顺序表中Li以前K、Ca、Na、Li②加热反应:Mg、Al、Mn、Zn、Cr、Cd、Fe、Ni、Cu、③不反应Ag、Pt、Au④钝化现象Cu、Pb、Su、Cr、Al形成保护膜Zn、Mg、C
无机化学二、金属与H2O的反应,酸的作用金属与H2O酸反应情况,一是与反应物本性有关,即与金属的活泼性和酸的性质有关;二是与生成物的性质有关;三是与反应物温度,酸的浓度有关。课堂提出:p640标准态H1/H2=0-0.41V从那儿
无机化学三、金属与碱的反应AlBeGaInSn两性金属可反应放出H2Zn+NaOH+2H2O=NaZnO2+H2四、金属与配位剂的作用湿法冶金 金属有机化合物五、金属间的置换反应活泼的置换不活泼的一般反应中,金属原于都是失去电子,显示还原性,但也有例外,CsAu中Au-是获得电子 ∵除卤素以外金的电子亲和势与其他元素都要高 ∴也可显负价,显示氧化性。
无机化学§4 合金定义:两种或两种以上金属元素(或其中一种是非金属元素)相互结合而成的、稳定的、具有金属性质的物质成为合金。例:锂合金铍合金(核时代金属、宇宙时代金属)…合金比纯金属更具有实际意义 ∵性能更优良类型:1、低共熔混合物:熔点低P区金属 两种金属非均匀混合物例焊锡63%Sn37%Pb熔点456
无机化学2、金属固熔体:当金属的晶体结构保持溶剂组元的晶体结构时,这种合金称为一次固溶体或端际固溶体,简称为固溶体。是组成物在固态下彼此相互溶解而形成的晶体,可看作为固态溶。根据溶质原子在晶体中所处的位置。分为:
无机化学在置换固溶体中,溶质原子位于溶剂晶体结构的晶格格点上;在间隙固溶体中,溶质原子位于溶剂晶体结构的晶格间隙。溶质原子在固溶体中的分布可以是随机的,即呈统计分布;也可以是部分有序或完全有序,在完全有序固溶体中,异类原子趋于相邻,这种结构亦称为超点阵或超结构。
无机化学此外,合金中溶质原子还可能形成丛聚,即同类原子趋于相邻。丛聚可以呈随机弥散分布。事实上,实验中还没有见到溶质原子呈完全随机分布的固溶体。因此,只能在宏观尺度上认为处于热力学平衡态的固溶体是真正均匀的,而原子尺度上并不要求它也是均匀的。不同类型固溶体中原子排列情况示于图0.1。
无机化学图0.1不同类型固溶体中原子排列示意图(a)随机置换固溶体(b)有序置换固溶体(c)随机间隙固溶体(d)固溶体中的溶质丛聚
无机化学3、金属化合物(互化物)当两种金属元素的电负性、电子构型和原子半径差别较大时,则易形成金属化合物,分为:金属间化合物可分为三类,即由负电性决定的原子价化合物(简称价化合物)、由电子浓度决定的电子化合物(亦称为电子相)以及由原子尺寸决定的尺寸因素化合物。除了这三类由单一元素决定的典型金属间化合物外,还有许多金属间化合物,其结构由两个或多个因素决定,称之为复杂化合物。
无机化学金属材料是传统的、经典的材料,所以既要总结其类型、特点,也要介绍一些新型材料,例如金属晶须、形状记忆合金、减振合金、功能材料 超导材料等。所以补充:一、形记金属:(形状记忆合金)具有与普通金属不同的特性——可逆的热弹性。我们知道,塑性变形是一种不可逆转的永久性变形。而形记金属却能在发生塑性变形后,稍稍加温便象“记住”了自己原有的形状而自动复原。这种现象为“形状记忆效应。”具有形记特性的金属材料有:Ni——Ti合金Fe—Pt、Au—Cd、Cu、Zn、Co合金等,其功能决定于晶体内部具有的特殊结构。
无机化学原理:当形记金属在一定温度范围内,由于发生塑性变形而形成某种几何外形时,其晶体内部的原子排列便形成同其外形相适应的可逆转变结构(亦称可逆的热弹性结构)。每种形记合金都有特定的可逆转变温度。在此转变温度以上将其轧制成欲记忆的材料,然后将其冷却到温度以下,改变形状到使用时,只要温度恢复形状也恢复。应用航天技术中的大型天线,工程技术中的方便铆钉、热能发动机。
无机化学二、金属晶须材料:一种胡须状铁晶须纤维(头发丝1/50~1/60)的抗拉强度能达到13400兆Pa,其强度是超高强度钢的5—10倍,若用它编织成直径为1mm的线材,可安全的另起1.07吨的货物。金属晶须是纤维是一种直径为几—几十微米,长度可达数厘米的卓晶体短纤维,它之所以具有极高的强度(接近于晶体的理论强度)取决于晶体内部原子的排列方式(或称细胞结构)。是无任何缺陷的完美晶体。三、金属玻璃:将某些金属熔融,以极快的速度骤冷,如冷却速度大于105K/S,则得到一种新的金属材料,无序状态被冻结类似于“玻璃”。
无机化学本章小结金属综述概述金属的提炼金属的物理化学性质分类存在、丰度氧化物的自由能-温度图提炼方法金属的精炼物理性质化学性质超导材料合金低共熔混合物金属固熔体金属化合物
合作学习目标1.了解中考作文类型。2.学会掌控作文分值。3.学会作文两种基本批阅方法(略批和详批)。合作学习方法:坐庄法,小组接力法,两人互助法。组内作文互批
一类文:35分——40分二类文:28分——34分三类文:21分——27分四类文:14分——20分五类文:14分以下评分依据:字数结构表达立意中考作文评分标准合作学习方法:坐庄法回忆总结,接力法回答。
1.全命题作文如《那年六一》注:在选材(形)立意(神)上产生分值距离。2.半命题作文我喜欢()半自由,半开放。注:在“题目补充”和“立意”上产生分值距离。3.材料作文同一段文字内容的阅读,不同的理解角度,有深,有浅。注:在阅读理解能力,命题,立意上产生分值距离。(方向)中考作文类型合作学习方法:坐庄法回忆总结,接力法补充回答。
一类文:35分——40分立意,表达,结构皆好。二类文:28分——34分结构完整,语言优美。三类文:21分——27分字数和结构完整,但立意大众,语言欠优美。四类文:14分——20分主题混乱,语无伦次。五类文:14分以下。辛苦分。评分依据:字数结构表达选材立意正能量注:结构(层次明晰,层层递进,突出主题)立意(区别大众题材,立意新颖,紧扣主题)组内作文略批方法合作学习方法:两人互助法。
1.找出错字别字圈出来。用波浪线画出好的句子。(语言的优美。)2.语序顺畅。(包括用词不当,语序颠倒,口语化较多。可批注修改。)3.命题和开头。(作文的领袖,不宜长)4.中间结构安排。(层次明晰,层层递进,主题突出。)5.结尾。(点题句,前后呼应,叙议结合,升华主题。)组内作文详批方法合作学习方法:两人互助法。
中考作文:打分标准、得分点、扣分点!五大类:一类卷(35—40分):符合题意,有新意,思想健康,感情真挚,中心明确,内容具体,语言流畅,条理清楚。二类卷(28—34分):符合题意,思想健康,感情真挚,中心比较明确,文字比较通顺,条理比较清楚。三类卷(21—27分):符合题意,思想健康,感情真挚,中心大致明确,内容大致具体,文字大致通顺,条理大致清楚。四类卷(14—20分):基本符合题意,思想健康,感情真挚,中心不够明确,内容不够具体,文字不够通顺,条理不够清楚。五类卷(14分以下):不合题意,中心不明确,内容不具体,文字不通顺,条理不清楚(不成篇)。'
您可能关注的文档
- 最新第15课-探寻新航路课件PPT课件.ppt
- 最新第16章 螺旋体课件PPT.ppt
- 最新第16章 螺旋体62440课件PPT.ppt
- 最新第17少年闰土657课件PPT.ppt
- 最新第18周--重叠问题1课件PPT.ppt
- 最新第17课宋朝的建立及其制度创设-修改课件PPT.ppt
- 最新第18篇-门静脉高压症病人护理课件PPT.ppt
- 最新第18章-止咳平喘药课件PPT.ppt
- 最新第18课-中国社会主义经济建设的曲折发展课件PPT课件.ppt
- 最新第1章 咨询心理学 心理咨询的含义课件PPT.ppt
- 最新第1单元—数一数(1)课件PPT.ppt
- 最新第1章--解表药-第2节(1)课件PPT.ppt
- 最新第1章-Java开发入门课件PPT.ppt
- 最新第1章-绪论课件PPT.ppt
- 最新第1章matlab语言的基础知识及入门课件PPT.ppt
- 最新第1章引论.课件PPT.ppt
- 最新第1章护理学的发展史课件课件PPT.ppt
- 最新第1章小信号放大器2小信号放大器汇总课件PPT.ppt