- 2.40 MB
- 2022-04-29 14:34:07 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'特殊人群的人机设计考虑.
由于各种原因,大部分老年人的身高比他们年青时矮5%。老年人的身高不再以每十年10mm的速度增加,反而由于脊柱收缩,这个岁数的人开始驼背。矮个老年女性由于同样的原因要变矮6%。手部力量下降约16%-40%。臂力下降约50%。腿部力量下降约50%。肺活量下降约35%。随年龄增长体形变小。鼻和耳朵的尺寸变大。体重每十年增加4.41磅(2kg)。一、形体特征:二、与衰老有关的特征老年人
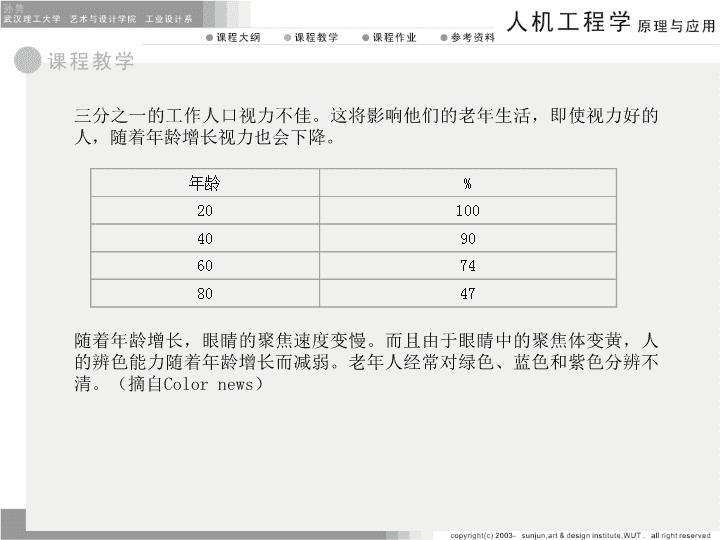
三分之一的工作人口视力不佳。这将影响他们的老年生活,即使视力好的人,随着年龄增长视力也会下降。年龄%20100409060748047随着年龄增长,眼睛的聚焦速度变慢。而且由于眼睛中的聚焦体变黄,人的辨色能力随着年龄增长而减弱。老年人经常对绿色、蓝色和紫色分辨不清。(摘自Colornews)
公共机构也应遵守这项法律,这些机构包括:各级政府机关。各部委、机关、特别行政区以及各级政府部门。国家铁路客运公司和其他官方运输公司。汽车、火车和其他大众交通工具中(除了飞机),在定时定点和连续性的前提下,需要为残疾人提供任何面向大众的普通或特别服务(包括包租服务)。可以不履行上述义务的地点包括:私人俱乐部、宗教场所、崇拜场所,除非这些场所的某个部分被公众使用。
国际通用的轮椅通道符号。聋哑人通道符号。国际TDD符号,TDD是聋哑人电信通讯设备。二、常用的标识符号
法律要求残疾人通道上、墙的凸出物包括标志在内不能超过102mm;邮筒或桥塔上的凸出物不能超过305mm;在水平方向,距地686mm,到距地2032mm内不能有障碍物;而且所有走廊和狭小空间的最小净高是2032mm。加宽门或使用偏心合页使轮椅能够通过。安装可使通行方便的小五金。取消旋转门或另外设置其他通道。移去松散堆积的地毯。在楼梯处附设坡道。在人行道和人口处设置坡道。调整家具、售货机、广告牌和其他可能的障碍物的位置。改变电话的位置。三、用于保证建筑无障碍的方法
改变坡度。电梯控制或标志符号立体突出。安装闪烁警示灯。运输工具加装手控装置。为残疾人指示专用停车场。在卫生间内安装扶手。调整卫生间内的隔墙以增加回旋空间。脸盆下的管道要有隔热装置,以防止烫伤。卫生间安装坐桶。在浴室内安装落地镜。改变浴室内毛巾架的摆放位置。放置纸杯,以方便够不到饮水器的饮水者
1、轮椅设计标准尺寸mm手柄高度扶手高度膝部高度座面高度脚部高度目视高度总宽总高脚踏板宽度9157606854852051090-12956601065*455*脚在此基础上还可向外延伸150mm;对于身材较高者可适当延长。四、轮椅
最小净面积:760mm×1219mm(左右方向*前后方向)轮椅向前进入小于610mm进深的凹室时所占的面积:760mm×1219mm。轮椅向前进入大于610mm进深的凹室时所占的面积:915mm×1219mm。建议门宽为915mm,门宽不小于815mm。最小门厅宽度为915mm。当两个轮椅时,建议门厅宽度为1625mm。最小房间宽度为1525mm。轮椅旋转一周的直径为1525mm。用于回转180°的“T”型空间,各方向的净宽不小于915mm,各方向深度不小于1525mm。2、轮椅所占的净面积和活动时所占的空间如下:
前面(脚尖贴墙):3、轮椅向上和向下的触及范围向上:最高1219mm,向下:最低380mm。
侧面,轮椅与墙之间的间距小于255mm;向上:最高1370mm,向下:最低230mm;建议最低取380mm。侧面间隔有宽610mm、高865mm的平台时:触及高度1170mm。
4、路缘、门槛和轮椅坡道通行无阻的道路不应包括台阶,但可以有自动扶梯。二者必居其一。请看残疾人专用坡道图。
路缘石板的最小宽度为915mm。坡道坡度不应超过1:20,而且端部的坡度不应超过1:10。如果人行道长度小于1219mm,那么端部的坡度不能超过1:12。对于9m长的独立坡道来说应该有1:12到1:16的坡度,对于12m长的独立坡道来说,最小应有1:16到1:20的坡度。方形台阶的最大高度限制在6.5mm,如果高度为6.5-13mm,则需要1:2的坡度。包括休息平台的最小坡道宽度为915mm。休息平台的长度至少1525mm。休息平台的宽度应允许轮椅调头,需要1525mm×1525mm。
扶手高度在865-965mm之间。如果扶手不连续,在末端应与地面平行延长305mm。扶手尺寸:直径32-38mm。为了便于握住扶手,扶手与墙之间至少留出38mm的空隙。扶手不得旋转。
轮椅在坚硬、稳定、规则的地面上活动起来很方便的。而在软的、松散的地面,象沙地、石子地面、泥地和粗毛地毯上活动十分困难。6、轮椅紧急出口在通往出口的通道上,两侧扶手之间应留出1219mm空间以保证可以抬出轮椅上的人。5、轮椅使用者对地面的要求
为坐轮椅者设计脸盆时,水槽的最大深度为865mm。脸盆至少从墙面伸出730mm。上缘距地面最大高度为735mm。脸盆下放腿的最小净空间为685mm。为防止使用者被烫,水管保护层距地面高度不大于230mm。底部水管从墙面凸出部分最大为150mm。脸盆前边缘处膝盖的最小空间为205mm。镜子高度:镜子底边距地面高度不小于1015mm,镜子顶边距地面1880mm。全身镜应有附加部分适合于所有成年人和儿童的需要。在脸盆下面应有一块760mm×1219mm的完整空间。7、坐轮椅者使用的脸盆
喷水管的高度,从喷口距地面的最大高度为915mm。膝部净空间为最小685mm。水管保护层:与脸盆部分相同。无论从侧面或正面使用,地面应留出大约760mm×1219mm的空间。8、轮椅使用者的饮水设施9、轮椅使用者的电话亭电话放置平台:长710mm,进深455mm。膝部净空:不小于685mm。边墙之间的入口宽度:915mm。边墙进深任意。
小便池距地高度不大于430mm。小便池边缘应该延长。坐便器高度为455mm,可适用于任何人。距墙边距离:最小为455mm。扶手:直径32-38mm。扶手安装高度:840-915mm。门后的扶手长度:915mm。边墙扶手长度:最小1065mm,距后墙305mm;如果使用长度为915mm的扶手,尺寸同上,但只在两边设置扶手,而后墙不设。纸卷架中心线的高度:最小为485mm,距后墙不超过915mm。10、轮椅使用者使用的厕所和小便池设计厕所和小便池时应考虑以下因素:
考虑到轮椅通行,电梯门宽至少915mm。满足条件的电梯有两种:1、电梯向一边开门,轿厢内部最小宽度为1730mm,最小进深为1290mm。2、电梯门在中线上,轿厢内部最小宽度为2030mm,最小进深为1229mm。由于门在中间,所以控制板可以安放在门的任意一侧。11、轮椅使用者乘坐的电梯要注意电梯控制钮和其他构件的特征:
楼层标志应该凸出而且发亮。同时应设置成盲文以满足盲人的需要。电梯轿厢侧壁上按钮的高度不应超过1370mm,前壁上的按钮其高度不应超过1219mm。急停钮的中心线到装修后地面的距离不能小于890mm。轿厢平台与电梯井的任一边的间距不能超过32mm。电梯楼层显示板位于控制面板上方或门的上方。当电梯行进或停止时,楼层显示灯就会闪烁而且发出声响。楼层数字的最小高度为13mm。音响不能低于20分贝且频率不能高于1500HZ。所有电梯井内的检修孔都应有楼层标志,这些标志高51mm,设置在两边的门框上。这些标志与装修后地面的距离为1525mm。指明电梯上下的指示灯应安装在距地面1830mm处,它们的最小高度为64mm。呼叫钮的直径最小为19mm。其中心线距地面高度为1065mm。控制钮应凸起或闪烁,直径不小于19mm。建议楼层标志设在按钮左侧。最底一排左侧的按钮是急停钮,在它的左边设置一个八边形的急停标志。急停钮的上面是“关门”按钮,它的左边是“开门”按钮。
TDD(聋哑人通讯设备)是为听力受损和交流障碍者使用的。TDD(有时称为文字电话)有一个读出显示器和一个输入文字的键盘。TDD可以象磁卡电话一样使用。文字电话需要一个255mm×255mm的平台,竖向最少150mm的净空,使用便携式文字电话。在这种情况下,需要提供10伏的电源、足够长的听筒线和投币设备等以配合便携式文字电话使用。TDD还需要有接发传真功能。坐在轮椅上所能触及的最远点(投币孔或按键)距离侧面不能超过1370mm,前面不能超过1219mm。在半封闭的电话亭中,悬出台面距地面高度不能小于685mm,以帮助和保护使用手杖者。若悬出深度低于610mm,墙的最小间距为760mm;若悬出深度高于610mm时,墙间距最小为915mm。在这两种情况下,平台板应有一个100mm的凹槽(平台板应与一侧墙平齐)。半封闭的电话亭可以用墙围合或安装在柱子上。在集会区应安装助听系统。这些系统用聋哑人的国际通用符号来标识。五、聋哑人的通讯设备
在音响信号上加上视觉信号。强化符号和图案的印刷效果。提供传真。加大音响信号的音量,如:扩大电话和铃声的音量。提供文字电话。为聋哑人设计时应考虑的因素
虽然训练导盲犬可以避开危险和绕过障碍,但大部分盲人在两种地方使用手杖。一种是在陌生的场合,另一种是在熟悉的环境。1)手杖从一边到另一边以弧形摇摆并敲打地面,可以触及到肩膀以外150mm的物体。这样,可以检查到墙和高度不超过685mm的障碍物。如果盲人的手或胳膊碰到超过685mm的障碍物时,很容易受伤。2)手杖使用者手持手杖成对角线方向,手杖的探头触及肩膀前的地面和另一肩膀前的部分地面。由于安全原因,楼梯下面685mm至2030mm的范围内应该封闭。六、为盲人设计
为了保障沿墙行走安全,当通道保持至少915mm的最小宽度时,可以允许地面上有不高于685mm的障碍物。在通道沿墙方向,如果广告箱的高度在685mm以上;最多可以挑出100mm。靠墙安装的物体如电话亭,如果平台板不高于685mm,允许挑出。靠柱子安装的电话亭可从柱挑出305mm,而且不受必须低于685mm的限制,因为手杖可以先碰到柱子。头顶上的标志不能太低,必须保留头顶的净空,距地面高度不能低于2030mm。地面上的格栅孔在前进方向上的最大尺寸13mm。长于这个尺寸,必须垂直于前进方向安装。行走困难和使用拐杖走路的人很容易滑倒或绊倒,所以走廊或楼梯地面必须安全。其他对盲人的保护措施如下:
头顶上标志安放的高度应大于2030mm,而且大写字母高度不小于75mm(不要求全部大写),保证在23m外可以看清楚。在4.6m的近距离观看时,字母高度不小于为16mm。所有字母的宽高比应在3:5到1:1之间,每一笔画的宽高比在l:5到1:10之间。凸出的有盲文特征的标志,安装时标志中心距地面1525mm。标志下面应配有16-50mm高的字母并凸出O.79mm,以满足2级盲文的要求。标志设置要远离危险区。各种房间和空间场所需要设置永久性标志。标志
在危险区域周围设置152mm宽的路缘,1067mm高的栏杆。避免凸出物、悬挂、较低的障碍物以及一切可能引起摔倒的危险因素。避免开敞楼梯和台阶鼻突。地面上小于等于15mm的洞不妨碍手杖的使用。正交格栅开孔比弯曲回旋格栅的开孔更合适。使用盲文。凸出的标志厚度宜为l0mm,并且设置在距地面1500mm处。扶手背面隆起或安装门把手会导致危险。在视觉信号标志上加装音响信号。气体测距比电子测距好,因为它们可发出声响。坚硬的表面可以帮助盲人探听声音。层面的变化要尽量减少以防止发生绊倒事故。为盲人和弱视者设计时应考虑的因素
第八章受体的放射配体结合分析技术受体是细胞膜或细胞内的大分子,它的作用是和细胞外的信息分子呈特异性结合,然后将信息转变为细胞效应,因此受体的功能是识别和信息转导。
受体的进一步解释:受体是细胞膜或细胞内的一些能首先与生物活性分子(药物,毒素,神经递质,激素和抗原)相互作用的分子,它们具有三个相互关联的功能:(1)识别和结合,即通过高亲和力的特异过程,识别并结合与其结构上具有一定互补性的分子-配基(2)转导信号:受体和配基相互作用产生信号,传递到效应器,如酶,离子通道等,使它们的活性或构象发生与导致生理效应相适应的变化.
(3)产生相应的生物效应:效应的强度与体外实验所测得的激动剂亲和力的大小相应.当然,如果受体所结合的是秸抗剂,则应表现为生物效应的阻断作用.受体鉴定的标准:饱和性高亲和力立体选择性可逆性靶组织的专一性存在竞争性拮抗剂具有内源性配基受体配基结合诱发生理效应
受体的分类:神经递质受体激素受体摄取血浆蛋白或转运物质的受体细胞黏附受体直接参与免役功能的受体药物受体毒素受体病原体受体
受体的放射配体结合分析是建立在放射性标记配体和受体间的理化结合反应,通过反应给出一定量靶组织或靶细胞中能与配体结合的受体数,用结合位点数表示,另外通过多点测量,经数据处理可给出受体的亲和力(常以平衡离解常数表示),应该指出,受体测定结果应与该受体的结合特性和介导的生物效应作综合分析,作出正确判断。
受体与疾病受体与疾病的关系主要表现在两个方面:一方面:受体的变化导致疾病的产生和加重其发展,另一方面:在疾病过程中产生了受体的变化。以受体改变为起因的疾病,称为受体病多种原因引起的很多疾病中所产生的受体的改变,也成为研究这些疾病的防治的主要方面。可分为以下几种。
疾病时受体的变化(1)受体数目的变化有很多疾病出现受体数目的变化,其中以胰岛素受体的变化最为显著。例如:肥胖症是一种因胰岛素数目减少而发生的疾病,这种病人单核细胞或脂肪细胞中胰岛素受体数目明显减少而亲和力不变。
(2)受体亲和力的变化包括两种完全相反的变化。一种是受体亲和力增加例如:肢端肥大症和胰腺瘤时,胰岛素受体亲和力增加。甲状腺激素使儿茶酚胺受体的亲和力增加等;
另一种是受体亲和力降低,例如哮喘病人外周血液淋巴细胞β受体,在最大结合容量减少的同时,伴有亲和力的降低。某些类型的受体的自身抗体亦可使相应受体的亲和力减弱。
(3)受体特异性的变化受体的特征之一是具有高度特异性,即特定的受体只与相应的药物或激素等配基相互作用。但是,有时这种特异性并不严格。一种受体除了对本身的配基具有很高的亲和力外,还能以低亲和力与另一种或多种激素或药物等结合,即表现为兼并性。
在正常情况下,受体可能完全不与这些配基起反应,但当后者过量时,两者就会相互作用,并产生一定的效应。这种情况称之为受体特异性的外溢。主要发生于某些病理状态。(4)受体的自身抗体多数受体的化学本质是蛋白质,它们都有抗原性。大量实验表明,在受体蛋白质上存在特异的抗原决定簇。
但是,由于免疫自稳作用,正常机体并不产生受体的自身抗体。然而,由于遗传缺陷的内因存在,或在感染等外因作用下,机体不能免疫麻痹自身抗原,破坏了原有的免疫动态平衡,发生了对受体的病理免疫反应,因而表现为自身免疫病。受体的自身抗体有下列作用:①加速受体降解、降低受体浓度,使之不足以介导正常的生物效应;
②阻断受体与激素结合,造成一种抗激素状态;③模仿正常情况下被激活的受体的作用。具有前两种作用之一的自身抗体,统称为封闭性抗体;如β受体和烟碱型乙酰胆碱受体的自身抗体,它们能与相应的抗原(即受体)结合,形成免疫复合物,从而导致受体数目减少,或亲和力下降,或两者均有之,干扰了受体与激动剂结合,最终导致靶细胞的功能低下或完全丧失。
对于能模仿激动剂作用的抗体,则称之为刺激性抗体;困为它们能激活受体,使靶细胞功能异常亢进;胰岛素受体的抗体即属于这一类。受体的自身抗体通常为IgG,遇见属于其他Ig类型的抗体。例如:重症肌无力的病因是由于产生了烟碱型乙酰碱受体的自身抗体。促甲状腺激素受体自身抗体则患弥漫性毒性甲状腺肿;
胃泌素受体自身抗体形成伴有恶性贫血;β受体的激动性自身抗体导致哮喘和过敏性鼻炎等。(5)受体-效应器偶联机理异常受体-效应器偶联机异常亦称之为“受体后缺陷”。常见于胰岛素和甲状旁腺激素受体的变化;后者为例,主要是其受体的信号转导系统的改变:与其相偶联的Gs的数量减少,而Gi则是正常的。这种变化的结果是,与腺苷酸环化酶解偶联,cAMp的生成量减少。
2、受体理伦在疾病研究中的应用(1)探讨疾病的发病机理以高血压发病的β受体失敏为例,在血管平滑肌的细胞膜上存在着多种物质的受体。其中β受体、前列腺素、腺苷和5-羟色胺等的受体被激活可导致血管扩张;这些受体都是通过激活腺苷酸环化酶(AC),增加cAMP的含量,进而产生效应。而α受体是介导血管收缩效应的受体。如果交感神经功能亢进,所释放的递质持续增多,它们持久地作用于β受体,可导致β受体AC系统的活性降低。
从分子水平观察,此时AC的调节亚基与催化亚基解联,使后者难以正常催化由ATP转变为cAMP的反应。由于这一系统对其他介导血管扩张作用的受体(PG,腺苷和5-HT)是通用的,它的功能障碍导致这些扩张血管物质的作用减弱,从而表现为血管扩张反应迟钝。与此同时,过量的递质会与α受体结合,使之过度兴奋,导致血管收缩。这两种效应的最终结合即表现为高血压。β受体阻断剂治疗高血压有效,从实践上证明上述解释是正确的。
(2)从受体变化寻找疾病的病因主要包括免疫学异常和遗传缺陷的疾病。很多自身免疫疾病是由于受体的自身抗体引起的,如乙酰胆碱受体的抗体所致的重症肌无力,促甲状腺受体的抗体所致的弥漫性毒性甲状腺肿等。根据这些自身抗体对受体的作用,可将其分为封闭性和刺激性两大类。
封闭性抗体能通过与受体结合,竞争性地抵制配基与受体相互作用;此时尽管激动剂的水平是正常的,也不能引起应有的生理效应,因为受体已被自身抗体占领;N受体的自身抗体属于这一类。刺激性抗体能模仿受体-激动剂的某些效应,使受体处于异常的活跃状态,表现为某些功能的亢进;促甲状腺素和胰岛素受体属于这一类。
(3)根据受体测定结果选择治疗方案例如:以乳癌的治疗为例,除手术治疗外,还可以采用内分泌疗法和化学治疗。但是,病人适合于什么治疗,取决于癌细胞中是否存在雌激素和孕酮受体(ER和PgR)。以同时存在雌、孕激素两种受体时内分泌疗法效果最好,而当两种受体均为阴性时化学疗法才能有效。实验证明,受体阴性的癌细胞的增殖速率比受体阳性者快得多;因此,它们必然摄取较多的具有细胞毒性的化学治疗物质,故对化学疗法敏感。
在乳癌的非手术治疗中,ER和PgR测定已被列为决定治疗方案前的常规检查。糖皮质细胞中GR浓度很低,则上述药物的治疗效果往往很差。这可能是因为在急性白血病时,缺乏正常量和正常功能的GR。
(4)受体变化作为疾病预后的指标ER阳性的乳癌病人的存活时间和术后的缓解期,都要比受体阴性者长一些。在急性淋巴细胞性白血病患儿髓中GR的检查结果表明,凡是GR水平低下者,即使经过治疗有所缓解,也往往迅速复发。(5)受体研究可直接为疾病寻求防治措施霍乱弧菌所产生的外毒素(CT),是通过细胞膜上单唾液酸神经节苷酯(GM1)作为受体而发挥作用的。体外实验表明GM1能阻断CT与膜上的GM1结合;抵制CT的
生物效应;从溶液中将CT沉淀下来。根据GM1的这些特征,已将它制成适当的制剂,在治疗霍乱中取得了较好的效果。放射配基结合法基本原理:是利用受体和配基结合的专一性以及放射性同位素测量的高灵敏度的特点,用放射性核素标记配基(*H),在一定条件下,使其与受体(R)结合,形成受体一配基复合物(R*H),测量R*H的放射性活度。可用下式表示:R+*H=R*H
放射性标记配基结合实验的目的是观察和确定放射性标记配基和受体间的物理化学相互作用。
式中,*H不仅和受体呈专一性结合,还和非受体组织蛋白(P)呈非专一性结合,形成P*H。虽然,非受体蛋白和*H的亲和力比受体小,但其浓度要比受体蛋白大得多,因此P*H值可以很大,干扰对R*H的测定。如何减少P*H值是放射配基结合法能否成功的关键。解决的办法是:
1、利用*H和R的亲和力高,同P的亲和力低这一特点,尽可能用低浓度的*H。但(*H)浓度低,(R*H)值也低,为了达到仪器可以测量的程度,应当尽可能用高放射比度的标记配基。2、利用*H和R的专一性结合的特点,应当尽可用高纯度的标记配基。3、利用受体蛋白容量少,可饱和性,而非受体蛋白高容量,非饱和性的特点,加浓度为*H100~500倍的非标记(H),以校正非特异结合,可用下式说明
P+R+*H=R*H+P*H(A)P+R+*H+H=RH+P*H+P*H(A)(H>>*H)(A)dpm-(B)dpm相当于(R*H+P*H)-P*H根据上述原理,放射配基结合法必须具备以下条件:(1)标记配基为了保证标记配基的比放射性、放射性纯度、稳定性以及是否适用于专一结合,应注意以下几方面:
①配基选择。组织内受体量很少,在进行分析时必须选择同受体有高亲和力的激动剂或拮抗剂,在较低的配基浓度即能保证得到专一性的最大结合率。专一拮抗剂优于激动剂,一般要求标记配基的浓度最好能小于受体配基络合物的解离常数。
例如:最常用的是3H标记物,其比放射性应大于3.7×1010Bq(10Ci)/mmol。优点:比较稳定,生物学效应不致改变,半衰期较长,也比较容易合成高比放射性标记化合物;缺点:须由专门实验室合成。125I标记物:优点:是可获得高比放射性的配基,如高达到3.7×1010Bq(1000Ci)/mmol以
上,并可在一般同位素实验室内合成;缺点:配基必须含有芳香族羟基,如酪氨酸残基,在配基分子中,参入一个碘原子一般不会影响它的生物活性,但参入二个以上的碘原子时,会降低配基的生物活性。此外,在标碘过程中,也可引起配基分子的改变。碘化的配基与原来的配基不完全相同,且不易纯化。另外,125I标记物的半衰期只有二个月。
②检测标记配基的放射性纯度。常规结合实验只有大约10%的标记配基与组织受体结合,因此放化纯度应在90%以上。最常用的纯度检查是薄层层析,有时也可用核磁共振检查配基分子结构的细微改变。经过纯化后的样品,在使用前还应该作放射性浓度测定。
③样品的贮存。样品应放在密封避光瓶中,必要时加入抗氧化剂低温保存。④监测标记配基是否变质。在结合实验中,最好先检查标记配基是否发生改变。其办法是将配基与相应的膜受体制剂温育,在反应终止时,抽提结合在组织受体上的放射性物质,用TLC法分析纯度,其Rf值在保存期间应该保持一致。
(2)受体组织建立受体结合实验时,首先,应该充分考虑选用合适的生物组织,该组织应含有对特定配基有生物学反应的受体。在一定条件下,受体的结合量与受体组织浓度呈线性关系。就多数配基来说,专一结合与受体的浓度呈直线关系。随着受体组织浓度的继续增加,专一结合出现下降趋势,表明温育时,标记配基有被组织分解的可能性,或者是组织内存在着内源性配基。
这种内源性配基对标记配基,起着干扰作用。就很多受体来说,另一个可能性是标记配基的亲和力的下降等于或超过结合部位数目的增加,这时组织量结合效应曲线可能向下曲折。为了得到更精确并可重复的结合数据,正式实验应该选用线性范围内的组织浓度。
其次,还应该确定专一结合是否限于已知含有这些受体的组织或器官。例如,所研究的受体,已知只存在于中枢神经系统,则专一结合就不应该在其他器官,如肺、肾、心、肠等内出现。
受体制剂的制备方法很重要。多数神经递质的受体结合实验,采用洗过的脑组织匀浆。一般先用匀浆器或超声波粉碎器,以50~100倍容积的的非等渗缓冲液或蒸馏水将脑制成匀浆,然后离心,将沉淀物捣碎,再用上述溶液洗涤一次以上,除去可能存在的内源性物质,以避免对专一受体干扰。
(3)温育条件①缓冲液。对神经递质受体结合实验最适宜的缓冲液是经过反复实验后确定的,包括最适宜的浓度与pH。常用的无机缓冲液是Na+-K+磷酸溶液,有机缓冲液是Tris溶液。为了研究离子对受体结合过程的影响,可以采用不含无机离子的缓冲液。如钠离子可以改变阿片受体的反应性,降低受体与激动剂的亲和力,但不改变拮抗剂的作用强度。同样,硫氰酸盐和碘盐,可增加拮抗抑制脑受体结合3H-GABA的强度,但不影响激动剂的活性。
几乎所有受体结合实验的最适pH都在7~8,除总结合外,结合部位的专一性也随pH而变化,所以,最适pH确定后,最好保持不变。②时间与温度。受体配基相互作用与酶-底物间的反应相似,所以受体结合数据的数学处理基本上与酶化学研究相同。可以基本假定,即结合反应为“稳定态”,因此,结合实验必须在平衡条件下进行。早期结合实验往往温育不同时间,然后终止反应,从而观察到一个动态过程。
在有些情况下平衡几乎立刻达到,而有些受体结合实验竟需要60分钟或更长时间才能达到平衡。在受体结合实验中,达到平衡是指专一结合达到最高值所需的时间,这一时间为受华表结合反应的反应速度常数和解离速度常数的函数。在平衡时,这两种速度常数相等。由此可见,任何影响受体对配基亲和力的因素和处理都能影响达到平衡的时间。遇到这种情况,应该在进行动力学分析前,先确定足以达到平衡所需的温育时间。
既然受体与配基的结合速度和解离速度取决于温度,这就不难想象,配基结合的量和达到平衡时所需要的时间将受温度的影响。当最适温度确定后,就不宜随便更改。多数结合实验是在4℃和37℃进行。为了得到精确度、重复性好的数据,应该在同一温度或低于温育时(常常为4℃)的温度终止结合反应。因为,如果结合反应在4℃,终止结合却在室温,则络合物的结合和解离的速度会随着温度不同而有所改变。这种操作条件将得到很不可靠和可变的动力学数据。
(4)结合和游离配基的分离法受体结合反应达到平衡时必须将反应体系中结合和游离的配基分开,也就是终止结合反应。分离技术要要考虑给定温度,配基从受体解离的速度。已知,受体与配基多以非共价键的形式结合,所形成的受体配基复合体解离甚为迅速,这就要求分离应在尽量短的时间内完成。若以已结合配基解离一半的分离时间为1,则解离受体配基复合体的10%,需要时仅为0.15×t1/2,而10%的解离已是最大的容许量了。如何来决定分离时间呢?这决定于平衡解离常数KD值,大多数受体与配基相互作用顺反应的结合速率常数不大于10-6mol/(L·s)。
1)过滤法。这是最常用的分离方法。采用美国Millipore公司生产的1225型过滤器,或者国产的多头细胞收集器,可同时抽滤12个样品。使用这种方法时,要注意选择合适的滤膜,细胞应选择孔径为1μm的滤膜,若为组织或细胞膜制剂,可选用小于0.2μm。一般用What-matGF/F,也可用国产的海光49型玻璃纤维滤纸。不同的受体可用不同的滤纸,如表皮生长因子用醋酸纤维滤膜,植物凝集素用尼龙滤膜等。
过滤过程一般为10~20s。如果受体络合物的解离速度太快,就易丢失结合的配基。一般,淋洗操作应在低温约0~4℃进行,结合试验在4~37℃进行均可。经过充分淋洗,过滤法比离心法可得到更大的专一结合与非专一结合的比值。当络合物解离常数在10-9~10-11mol/(L·s)范围,本法是很有效的。通常用5~10ml不含配基的冷缓冲液淋洗滤约2~3次,最后经70℃烘干,置于闪烁液中计数。
过滤法最突出的缺点是由于滤膜吸附了游离的标记配基而增加了非特异结合。可在缓冲液中加入适量的牛血清白蛋白或明胶以减少吸附。2)离心法。多数结合实验可用离心法终止。经温育后,将样品在5000g离心10min。离心时,样品始终同配基处于平衡状态。这样,结合受体不致丧失配基。离心后,将上清液倾去,用冰冷的缓冲液或水淋洗沉淀物。淋洗操作要快,只需淋洗沉淀物的表面,以免结合配基的丧失。
淋洗要重复一、二次,然后用适当的助溶剂将沉淀物溶解,最后将混合液合并,加入闪烁液,在液闪仪上计数。其缺点是由于膜沉淀物在离心后未经充分淋洗,而可能混入非专一结合的放射性,3H计数往往比过滤法高。同样,也可能有相当数量的放射性附着在离心管壁上,故管壁也要彻底淋洗。此外,由于沉淀物致密,游离的配基也不易彻底洗。
3)平衡透析法。将标记配基受体组织用半透膜隔开,当标记配基自由地透过膜到达平衡时,游离标记配基浓度在膜两侧相等,含受体制剂一边的标记配基总浓度为游离标记配体与结合配基之和。因此,结合配基的浓度为膜两侧标记配基浓度之差,所以只有当这个差值有意义时,平衡透析才可靠。当受体浓度在受体配基络合物的解离常数范围就可得到较好的结合数据。若当受体浓度远远高于络合物的解离常数,其中大部分加入的配基被受体结合,而游离配基浓度很低。
或当受体浓度远远低于络合物的解离常数范围时,在含受体制剂的膜的两侧,只有小部分标记配基处于结合状态,而大部分为解离状态,因此,测得的结合配基的量只取决于膜两侧很小的配基浓度差,所以,这两种实验都是不可靠的。正常情况下,经过平衡后取出一部分受体组织与缓冲液,检测其放射性。
有受体组织一边的放射性与另一侧的差代表专一性结合。由于亲和力较低,在膜一边须加入大量受体制剂才能得到明显的结合。这样,即使用较高受体组织浓度,平衡透析法还有一个致命的缺点,即受体侧与缓冲液一侧放射性配基量差别很小,以致难以精确计算专一受体结合量。此外,还必须注意透析膜本身能否结合放射性配基,以免带入误差。
4)凝胶过滤。这是一种既适用于可沉淀受体,又适用于可溶性受体的方法,尤适用于从已增溶的受体制剂中将结合的与游离的配基分开。在实际操作中,大致有两种方法:A.先将受体制剂与标记配基共同反应,使达到目的平衡,然后将该混合物加入事先用反应液平衡过的凝胶如Sephadex柱上,通过洗脱,将与受体结合的配基同游离者分开,B.凝胶先以含有低浓度试放射性配基的洗脱液平衡,使达到过饱和;
再将受体制剂回到以这种凝胶填装的层析柱顶部,并以含有标记配基的洗脱液洗脱,监测洗脱液中的放射性,可见与受体结合的放射性配基形成了一个高于基线的“峰”,并随之以放射性计数的“谷”;根据峰与谷的放射性计数差,即可计算已结合的标记配基量。该法要求受体与配基的结合是高亲和力,亦即受体和配基的解离速率相对要缓慢。
5)沉淀法和吸附法。加入硫酸铵、盐析剂、酸以及聚乙二醇等物质,以降低受体配基复合体溶解度。该法在受体研究中应用比较广泛。吸附法是通过吸附游离的配基,而将结合的与未结合的标记配基分开。目前常用字的是葡聚糖覆活性炭(dextrancoatedcharcoal,DCC)法。该法是将惰性支持物活性炭,以葡聚糖之类的多聚碳水化合物包被,使之具有分子筛作用,增加了吸附的选择性;
小分子的游离配基可穿过葡聚糖“外壳”,被活性炭吸附,而大分子的受体配基复合体则不被除数吸附。DCC法在胞液受体的测定中得到了广泛的应用。当然,在具体操作中,对于活性炭的处理,葡聚糖的分子量等均有严格要求。5、降低非特异结合的方法放射性受体结合分析中配基既可被特异性受体所结合,亦可被细胞的其他组分及滤膜等生物和非牺牲物质非特异地吸附。
非特异结合至少包括三个部分:①真正与组织中非受全结合部位结合的标记配基。②吸附在分离物质包括滤膜、试管上的标记配基。③淋洗不充分而残存的、或吸附于沉淀中的标记配基。第一种情况较难以改变。由于通常在制备膜蛋白时采用差速离心法,因此,应增加首次离心力,减少杂蛋白的含量,以降低非特异结合。但这种做法并不总是有效。后两种情况则相对地容易解决。
除了通常在反应体系中加入浓度远高于标记配基的非标记的配基外,还可以通过比较不同的洗涤次数、变更所有缓冲液的pH值等,尽量除去游离配基,也可以向缓冲液中加入抗吸附剂,如清蛋白或胶原蛋白等,以降低分离物质的吸附作用。但是,这种抗吸附物质不宜过量,一般不超过0.1%,最好先确定它本身并不结合游离的配基。
饱和结合实验将浓度递增的放射性配基,与浓度固定的细胞组织制剂共同反应。使标记配基浓度递增的方法有两种:一是增加加入的标记配基量,但其反应体积和比放射性不变,从而增高反应体系中的放射值;二是固定反应体系中的标记配基浓度,通过增加非标记配基浓度,稀释标记配基的比放射性,以便在实际上造成标记配基的浓度递增。一般多取前者。
从理论上讲,受体-配基之间结合的动力学,颇类似于酶-底物的相互作用。以(R)为未被占领的受体浓度,(L)为游离配基的浓度,(RL)为受体-配基复合体的浓度,依质量作用定律得:(R)+(L)=(RL)此时,平衡结合常数既可由缔合常数(KA)决定即:KA=K1/K2=(RL)/(R)(L);亦可由解离常数(KD)决定,即:KD=K2/K1=(R)(L)/(RL)。
如果受体部位是一种类型,不存在异种受体,则配基与受体结合后,只有一个简单的解离常数KD,因此可从上式推导出Scatchard公式。从这处公式,便可以求得平衡稳离常数KD和最大结合容量Bmax。B/F=(Bmax-B)/KD式中,B代表受体特异结合,F代表实际加入的放射配基的终浓度。以B/F对B作图,所得曲线之斜率为-1/KD,从截距可求出Bmax。
例如:现以大鼠心肌内皮素受体测定为例,介绍受体测定的具体方法[5]。将鼠心迅速放入预先冰浴好的生理盐水中,剪除结缔组织,心房肌、心室肌称重后放入冰冷的匀浆液[内含20mmol/LNaHCO3,0.2mol/L苯甲磺酰氟(PMSF),pH7.4]中,比例为1:8,剪碎,用高速分散哭匀浆,速度为7000r/min,三次20s,间隔1min以利充分冷却,将匀浆液以1:20比例稀释。将稀释后的匀浆液在低温高速离心机上以1500g离心15min。取上清液在低温超速离心机上以40000g离心20min,弃上清液,用50mol/LTris-HCl液(内含0.2mol/LPMSF,pH7.4)10ml溶解沉淀,再以上速度离心20min,将沉淀用Tris液重悬稀释后,用牛血清白蛋白做标准以考马斯亮兰G-250法测定蛋白量。
3、动力学实验总配基浓度保持不变,以时间为函数,测定专一结合。结合达到平衡的时间决定于速度常数和受体及配基的浓度。其特异性结合的求法同上所述,以时间对In(Beq/Beq-Bt)作图,其中Beq代表结合达到平衡时,Bt为各时间的特异结合,并进行直线回归得结合动力学图(见表2.33)。以时间对In(Bt/Beq)作图,并作直线回归,可得解离动力学图。
4、竞争性抑制实验主要目的为测定IC50和Ki。IC50是指抑制50%结合的抑制剂浓度,Ki是指在标记配基平衡时,非标记配基与受体部位缔合之平衡解离常数。竞争性抑制是用一类高亲和力的拮抗剂(KD为0.001~0.1μmol/L),或激动剂,将标记配基转换下来。本例仍采用双管法,反应在37℃温浴中进行60min,配基浓度选定在44pmol/L,蛋白浓度为每管30μg,每管中加入未标记的ET1,浓度梯度为1pmol/L~1μmol/L。总反应体积为250μl,BQ-123(ET1受体的阻断剂)浓度为
10pmol/L~10μmol/L。硫氮唑酮及巯甲丙脯酸的浓度各选在1nmol/L~0.1mmol/L。计算每一浓度所对应结合百分数(B/B0),以竞争药物浓度的对数值为横坐标,以B/B0为纵坐标,绘制竞争结合曲线。将曲线通过分对数(lnI/100-I)转化成直线求方程,直线在横坐标上的截距为IC50。以图2.41所示结果为例,作图并求出使标记配基与受体结合量下降50%时,所需的非标记配基的浓度,即为IC50。IC50能反映非标记配基与受体的亲和力和专一性。IC50的求法很多,要采用半对数法,亦可用对数-几率单位法和对数logit法。
放射性配基结合法的应用和前景(1)阐明药物和激素递质的作用机制受体研究可对药物、激素、细胞因子、递质的作用深入到生物大分子之间的相互作用,涉及到细胞功能的触发阶段信号传导的机制。这是生物之间协调生命活动最初的信号传导过程。(2)探讨疾病的病因和发病机理研究证实胰岛素受体性能和数量不正常,可能同糖尿病、肥胖病有密切关系,另有些疾病由于受体合成受阻、更新率受限制以及产生了受体蛋白的自身免疫抗体等,阻止了受体各配基的相互结合,因而产生疾病。
(3)新药设计和药物筛选利用放射配基结合分析法筛选药物,简单、快速、结果可靠、所需样品量少。观察到某一药物对某一受体有亲和力将表明该药可能具有药理作用;如对多种受体或亚型都有一定亲和力,则表明药物专一性不高,可能出现副作用。此法缺点是不能反映药代动力学和药物到达受体部位等一系列生理生化过程。亲和力试验也不能完全鉴别激动剂和拮抗剂。因此,受体结合分析应该伴随动物和生物鉴定等工作。
(4)测定组织或血液中药物的浓度放射配基结合法可定量地测定生物样品中内源性物质和药物浓度。先作一已知不同浓度药物抑制放射配基与受体特异性结合的标准曲线,然后测定未知样品(组织或血样提取物)抑制该放射配基与受体特异性结合的百分率,从标准曲线即可查出未知样品中所含药物的量。该法具有特异性强、灵敏度高和快速简便等特点。'
您可能关注的文档
- 最新物质的分类第一课时2课件PPT.ppt
- 最新物象的立体表达课件PPT.ppt
- 最新物质跨膜运输的实例课件PPT.ppt
- 最新物质的量教学课件课件PPT.ppt
- 最新物质运输的器官—血管.课件PPT.ppt
- 最新物质跨膜运输的方式-ppt课件PPT.ppt
- 最新牵引护理课件PPT课件.ppt
- 最新特异功能课件PPT.ppt
- 最新特定人群的口腔保健[精华]课件PPT.ppt
- 最新特殊甲亢的诊断和处理课件PPT.ppt
- 最新特殊教育学_方俊明_视觉障碍儿童的教育PPT课件PPT课件.ppt
- 最新特殊骨折的命名(1)课件PPT.ppt
- 最新特点-低温诱导植物染色体数目的变化无籽西瓜的培育课件PPT.ppt
- 最新特种铸造基础知识..课件PPT.ppt
- 最新独石电容器瓷课件PPT.ppt
- 最新狗皮膏(改进型)详解(2)课件PPT.ppt
- 最新狼图腾PPT课件PPT.ppt
- 最新狼ppt课件PPT课件.ppt