- 746.00 KB
- 2022-04-29 14:27:57 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'物质结构、元素周期律
第一节.物质结构、元素周期律一.知识要点:(口诀)物质结构1.三种微粒六种量,两素概念算清帐;2.一种状态二原理,一套规律要记详;3.三键一力四数据,两种分子四晶体;4.四种符号四图式,一定联系周期律。元素周期律1.周期表格要牢记,变化体现周期律;2.七主七付七周期,VIII族零族镧锕系;3.同族金增非递减,同周金减非增递;4.元素排布分四区,三角变化有联系。
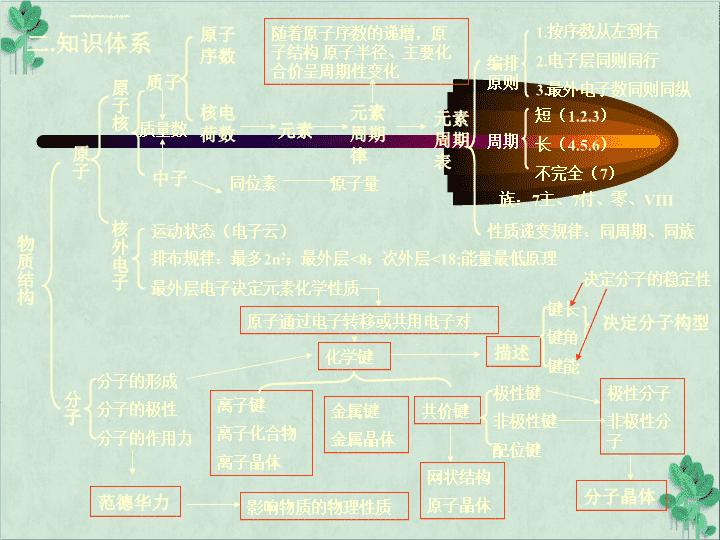
二.知识体系物质结构原子原子核核外电子原子序数核电荷数元素元素周期表元素周期律编排原则1.按序数从左到右2.电子层同则同行3.最外电子数同则同纵周期短(1.2.3)长(4.5.6)不完全(7)族:7主、7付、零、VIII性质递变规律:同周期、同族质子中子随着原子序数的递增,原子结构原子半径、主要化合价呈周期性变化质量数同位素原子量运动状态(电子云)排布规律:最多2n2;最外层<8;次外层<18;能量最低原理最外层电子决定元素化学性质原子通过电子转移或共用电子对化学键离子键离子化合物离子晶体共价键金属键金属晶体极性键非极性键配位键描述键长键角键能决定分子构型分子分子的形成分子的极性分子的作用力范德华力影响物质的物理性质网状结构原子晶体极性分子非极性分子分子晶体决定分子的稳定性
三.三种微粒六种量,两素概念算清帐.1.三种微粒1)比较微粒质量相对质量电性意义质子1.6726×10-27kg1.007一个单位正电荷决定元素的种类中子1.6743×10-27kg1.008不带电、中性决定同位素和质量数电子9.1095×10-27kg1/1836一个单位负电荷价电子决定元素化性原子核原子2)核组成符号AZX质子:Z个中子:A-Z个核外电子:Z个3)两个关系式原子序数=核电荷数=质子数=原子核外电子数(阴、阳离子=?)质量数(A)=质子数(Z)+中子数(N)
例1(99)“铱星”计划中的铱的一种同位素是19177Ir其核内中子数是A.77B.114C.191D.268例2(99)已知铱有两种同位素191Ir和193Ir,而铱的平均原子量为192.22,则两种同位素的原子个数比是A.39:61B.61:39C.1:1D.39:111.B2.A191x+193(1-x)=192.22(或用十字交叉法)例3(00)136C—NMR(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子A.核外有13个电子,其中6个能参与成键B.核内有6个质子,核外有7个电子C.质量数为13,原子序数为6,核内有7个质子D.质量数为13,原子序数为6,核内有7个中子D
例4.(20g)1999年新发现114号元素的同位素,其中子数为184,该同位素的质量数是A.70B.114C.228D.298D例5(93s)核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的量(mol)A.n(A-N+8)/(A+16)B.n(A-N+10)/(A+16)C.(A-N+2)D.n(A-N+6)/A氧化物为RO,质子数=A-N+8;式量=A+16;选A例6(95)178O和168O原子的核外电子数的比较A.大于B.小于C.等于D.不能确定C例7(99s)12553I可治疗肿瘤,其核内中子数与核外电子数之差是A.72B.19C.53D.125B
2.六种量量概念意义质子数质子的数目决定元素的种类和“位置”中子数中子的数目决定原子的物性和质量数电子数电子的数目价电子决定元素的化学性质质量数质子数与中子数之和决定原子的近似原子量元素平均原子量:A=A1•x1+A2•x2+A3•x3……元素近似平均原子量:A=A’1•x1+A’2•x2+A’3•x3……其中A1A2A3……为各同位素的原子量A’1A’2A’3……为各同位素的质量数x1x2x3……为各同位素的丰度或摩尔分数
四.一种状态二原理,一套规律要记详1.一种状态:核外电子运动状态1)电子云:电子在核外空间一定范围内出现,好象带负电荷的云雾笼罩原子核周围,人们形象地称它为电子云。2)电子层概念:能量高低不同和离核远近不同的空间区域符号:KLMNOPQ电子层数:1234567能量:低—————————高离核距离:近—————————远记忆
2.二原理1)最大容纳原理:每个电子层最多容纳2n2个电子。2)能量最低原理:电子在填入电子层时,先占能量低的电子层后占能量高的电子层。3.一套规律要记详:核外电子排布规律1)每个电子层最多排2n2个电子2)最外层8个电子,次外层18个电子,倒第三层323)先占内层,后占外层要求:主族元素和第四周期元素原子结构简图会写方法:记住每周期希有气体的结构简图IAIIA外延;IIIA~IIVA内推
例1(96)M电子层与L电子层最多可容纳的电子数的比较A.大于B.小于C.等于D.不能确定A
五.三键一力四数据,两种分子四晶体1.三键比较化学键概念作用点特征形成条件和规律示例离子键阴阳离子间静电作用离子无方向性无饱和性金属(NH4+)与非金属或酸根盐、碱金属氧化物共价键极性键非极性键配位键原子间共用电子对偏不偏一方提供不同原子相同原子特殊原子有方向性和饱和性原子有未成对电子电子云要重叠不同非金属元素之间同种非金属元素之间一方有孤对电子,一方有空轨道COHXX2O2H2O2H3O+NH4+金属键金属离子和自由电子间的静电作用金属离子和自由电子间无方向性无饱和性金属单质和合金相邻的两个或多个原子或离子之间的强烈相互作用
2.一力:分子间作用力(范德华力)1)概念:存在于分子之间的微弱作用力。(只有分子晶体有)2)意义:决定分子晶体的物理性质。如力越大熔沸点越高组成和结构相似:分子量越大,力越大。如熔沸点CF4HCl异戊烷>新戊烷3)影响因素:4)与化学键的比较化学键分子间力概念原子或离子间强烈相互作用分子间微弱的相互作用范围分子内或离子、原子、金属晶体内分子间能量键能一般为120~800kJ/mol约几个~十几个kJ/mol性质影响主要影响物质的化学性质主要影响物质的物理性质
3.四数据1)原子半径概念:成键原子核间距离的一半。变化规律:与离子半径关系:原子半径<相应的阴离子半径原子半径>相应的阳离子半径意义:原子半径的大小可判断得失电子的难易,大易失。比较微粒大小的依据(三看)一看电子层数:电子层数越多半径越大Na>Na+二看核电荷数:电子层数相同时,核电荷数越大半径越小。S2->Cl->Ar>K+>Ca2+;O2->F->Ne>Na+>Mg2+>Al3+三看电子数:电子层和核电荷数都相同时,电子数越多半径越大。Cl->Cl;Fe2+>Fe3+
2)键长、键角、键能概念意义键长成键两原子核间的平均距离键长越短键越强结合越牢固键能形成1mol化学键所放出的能量键能越大键越强结合越牢固键角分子内相邻两共价键之间的夹角决定分子构型,判断分子极性4.两种分子(极性、非极性分子)分子极性分子非极性分子概念正负电荷中心不重和正负电荷中心重和判断极性键、结构不对称非极性键或极性键、结构对称实例双原子CONOHXX2H2O2N2叁原子(AB2)V型H2OH2SNO2SO2直线型CO2CS2肆原子(AB3)三角锥型NH3PH3平面正三角BF3SO3(P4,C2H2)五原子(AB4)CHCl3CH2Cl2CH3Cl正四面体CH4CCl4
5.四晶体晶体类型离子晶体原子晶体分子晶体金属晶体概念离子间离子键原子间共价键分子间分子力金属离子和e金属键晶体质点阴、阳离子原子分子金属离子原子和e作用力离子键共价键分子间力金属键物理性质熔沸点较高最高很低一般高少数低硬度较硬最硬硬度小多数硬少数软溶解性易溶于水难溶任何溶剂相似相溶难溶导电性溶、熔可硅、石墨可部分水溶液可固、熔可实例盐MOHMOCSiSiO2SiCHXXOnHXOn金属或合金
物质熔沸点高低的比较1.晶体内微粒间作用力越大,熔沸点越高,只有分子晶体熔化时不破坏化学键2.不同晶体(一般):原子晶体>离子晶体>分子晶体熔点范围:上千度~几千度>近千度~几百度>多数零下最多几百度3.同种晶体离子晶体:比较离子键强弱,离子半径越小,电荷越多,熔沸点越高MgO>MgCl2>NaCl>KCl>KBr原子晶体:比较共价键强弱(看键能和键长)金刚石(C)>水晶(SiO2)>SiC>Si分子晶体:比较分子间力1)组成和结构相似时,分子量越大熔沸点越高F2异戊烷>新戊烷金属晶体:比较金属键,熔沸点同族从上到下减小,同周期从左到右增大。Li>Na>K>Rb>Cs;NaB>CB.B>A>CC.C>A>BD.C>B>AB.例12(96)关于化学键的下列叙述中正确的是A.离子化合物中可能含有共价键C.离子化合物中只含离子键B.共价化合物中可能含有离子键D.共价化合物不含离子键A.D例13(96s)下列过程中共价键被破坏的是A.碘升华B.溴蒸气被木炭吸附C.酒精溶于水D.HCl气体溶于水D.
六.四种符号四图式,一定联系周期律1.四种符号元素符号:AlS离子符号:Al3+S2-(SO42-)价标符号:Al+3S-2(SO4-2)核组成符号:2713Al3216S2.四图式化学式Na2O2NH4ClC2H4NH3电子式结构式结构简式3.周期律概念:元素的性质(原子半径、主要化合价)随着原子序数的递增而呈周期性的变化规律:原子半径同周期从左到右渐小,同族从上到下渐大。主要化合价:+1+2+3+4+5+6+70-4-3-2-1原因:核外电子排布随着原子序数的递增而呈周期性的变化(1~8)金属性、非金属性、还原性、氧化性、氢化物稳定性、最高价氧化物的水化物酸碱性
7.元素周期表1)周期表格要牢记,变化体现周期律,七主七付七周期,VIII族零族镧锕系元素周期表编排原则1.按原子序数递增的顺序从左到右排列2.将电子层数相同元素排成一个横行3.把最外电子数相同的元素排成一个纵行构造周期:表中的每一横行。短(1.2.3)长(4.5.6)不完全(7)族:7主(长短周期元素)、7付(仅有长周期元素)、零(希有气体)、VIII(8.9.10三纵行)镧锕系:为紧凑周期表而列在外。要求能画简易周期表(主族和前四周期)18纵7横,I~VIII;I~0。高A低B。练习记忆:1)原子序数:记两头推中间(1H+2+8+8+18+18+32+32)2)每周期所含元素(2.8.8.18.18.32.23)3)希有气体结构(内推本周期IIIA~VIIA,外推下周期IAIIA
2)原子结构变化规律同周期电子层数=周期序数最外层电子数从左到右1~7(8)同主族电子层数从上到下依次增大最外层电子数=族序数=价电子数=最高正价数
3)同族金增非递减,同周金减非增递内容同周期(从左到右)同主族(从上到下)电子层数相同(等于周期序数)逐渐增加最外电子数逐渐增加(1~8)相同(等于族序数)最高正价+1~~+7等于族序数原子半径逐渐减小逐渐增大离子半径阴阳离子半径均渐小阴阳离子半径均渐大得电子能力(氧化性)逐渐增强逐渐减弱失电子能力(还原性)逐渐减弱逐渐增强金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱最高价氧化物水化物酸碱性碱性渐弱酸性渐强碱性渐强酸性渐弱气态氢化物稳定性逐渐增强逐渐减弱
A.同周期元素性质变化规律族IAIIAIIIAIVAVAVIAVIIA最外电子数1234567原子半径大—————————————————————小得(失)电子能力弱(强)————————————————强(弱)氧化(还原)性弱(强)————————————————强(弱)最高正价+1+2+3+4+5+6+7对应氧化物R2OROR2O3RO2R2O5RO3R2O7对应水化物ROHR(OH)2R(OH)3H4RO4H3RO4H2RO4HRO4酸碱性碱性渐弱,酸性渐强最低负价-4-3-2-1对应氢化物RH4RH3H2RHR稳定性逐渐增强溶于水酸碱性碱性渐弱,酸性渐强
B.判断金属性和非金属性的依据证明金属性同条件下与水或酸,越易越强。最高价氧化物所对应的水化物的碱性,越强越强相互置换电化学:原电池的负极,电解时后还原金属性强证明非金属性最高价氧化物所对应的水化物的酸性,越强越强与H2反应的条件和生成氢化物的稳定性相互置换电解时后氧化的非金属性强
4).元素排布分四区,三角变化有联系位置性质结构最外层电子数电子层数(族)纵(横)周期原子序数相似性递变性1.主要化合价2.最高价氧化物及其水化物的组成3.氢化物组成1.金属性与非金属性2.“水化物”的酸碱性3.氢化物的稳定性
5)周期表的应用A.推断元素位置、结构和性质元素名称元素特征周期数、族数原子序数原子量物理或化学特性原子结构特征含量等其它特征元素的性质原子或离子结构最高或最低化合价根据分子式的计算根据化学方程式的计算
B特殊知识点找元素之最最活泼金属Cs、最活泼非金属F2最轻的金属Li、最轻的非金属H2最高熔沸点是C、最低熔沸点是He最稳定的气态氢化物HF,含H%最大的是CH4最强酸HClO4、最强碱CsOH地壳中含量最多的金属和非金属AlO找半导体:在“折线”附近SiGeGa找农药:在磷附近PAsSClF找催化剂、耐高温、耐腐蚀材料:过渡元素FeNiPtPdRh
C比较或推断一些性质比较同族元素的金属性Ba>Ca>Mg非金属性F>Cl>Br最高价氧化物的水化物的酸碱性KOH>NaOH>LiOH氢化物的稳定性CH4>SiH4比较同周期元素及其化合物的性质碱性:NaOH>Mg(OH)2>Al(OH)3稳定性:HF>H2O>NH3比较不同周期元素的性质(先找出与其同周期元素参照)推断一些未知元素及其化合物的性质预测88Ra的性质
例1(98)X、Y、Z为短周期元素,最外层电子数分别为1、4、6,则下列化合物的化学式不可能的是A.XYZB.X2YZC.X2YZ2D.X2YZ3A.B可为HCHO;C可为HCOOH;D可为Na2CO3例2(00)下列每组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是A.食盐和蔗糖熔化B.钠和硫熔化C.碘和干冰升华D.二氧化硅和氧化钠熔化C例3(99)关于晶体的下列说法正确的是A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子C.原子晶体的熔点一定比金属晶体的高D.分子晶体的熔点一定比金属晶体的低A.
例4(99)关于IA和IIA族元素的下列说法中正确的是A.在同一周期中,IA单质的熔点比IIA族的高B.浓度都是0.01mol/L时,KOH溶液的PH值比Ba(OH)2的小C.氧化钠的熔点比氧化镁的高D.加热时,碳酸钠比碳酸镁易分解B.例5(98)下列叙述正确的是A.同主族金属的原子半径越大熔点越高B.希有气体原子序数越大沸点越高C.分子间作用力越弱分子晶体的熔点越低D.同周期元素的原子半径越小越易失去电子B.C
例6(98)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为A.XYB.XY2C.XY3D.X2Y3A.X可能是Li(21);Si(284)Y可能是H和Li例7(98s)IIA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为A.MgB.CaC.SrD.BaB.C例8(98s)钛的同位素4622Ti、4722Ti、4822Ti、4922Ti、5022Ti中,中子数不可能为A.30B.28C.26D.24A.最小值46-22=24;最大值50-22=28
例9(97s)短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是A.M2+的离子半径比N2-的小B.M的原子序数比N小C.M和N原子的电子层数相等D.M和N原子最外层电子数相等A.M在N的下一周期例10(97)X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是A.a-c=m-nB.a-b=n-mC.c-d=m+nD.b-d=n+mD例11(97)铍的原子序数为4,下列叙述正确的是A.铍的原子半径大于硼的原子半径B.氯化铍分子中铍原子的最外层电子数是8C.氢氧化铍的碱性比氢氧化钙的弱D.单质铍跟冷水反应产生氢气A.C
例12(97)下列各组微粒中,核外电子总数相等的是A.K+和Na+B.CO2和NO2C.CO和CO2D.N2和COD.例13(97)19世纪中叶,门捷列夫的突出贡献是A.提出原子学说B.发现元素周期律C.提出分子学说D.发现氧气B.例14(96s)随着卤素原子半径的增大,下列递变规律正确的是A.单质的熔沸点逐渐降低B.卤素离子的还原性逐渐增强C.气态氢化物稳定性逐渐增强D.单质氧化性逐渐增强B.例15(96s)下列各组分子中都属于含极性键的非极性分子的是A.CO2.H2SB.C2H4.CH4C.Cl2.C2H2D.NH3.HClB.
4、教学必须从学习者已有的经验开始。——杜威5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基11、学会学习的人,是非常幸福的人。——米南德12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰15、学习是劳动,是充满思想的劳动。——乌申斯基16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东18、只要愿意学习,就一定能够学会。——列宁19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰20、对所学知识内容的兴趣可能成为学习动机。——赞科夫21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。53、希望是厄运的忠实的姐妹。54、辛勤的蜜蜂永没有时间悲哀。55、领导的速度决定团队的效率。56、成功与不成功之间有时距离很短只要后者再向前几步。57、任何的限制,都是从自己的内心开始的。58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。59、不要说你不会做!你是个人你就会做!60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。64、每一个发奋努力的背后,必有加倍的赏赐。65、再冷的石头,坐上三年也会暖。66、淡了,散了,累了,原来的那个你呢?67、我们的目的是什么?是胜利!不惜一切代价争取胜利!68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。70、平凡的脚步也可以走完伟大的行程。71、胜利,是属于最坚韧的人。72、因害怕失败而不敢放手一搏,永远不会成功。73、只要路是对的,就不怕路远。74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。24、凡事要三思,但比三思更重要的是三思而行。25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。26、没有退路的时候,正是潜力发挥最大的时候。27、没有糟糕的事情,只有糟糕的心情。28、不为外撼,不以物移,而后可以任天下之大事。29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。30、不屈不挠的奋斗是取得胜利的唯一道路。31、生活中若没有朋友,就像生活中没有阳光一样。32、任何业绩的质变,都来自于量变的积累。33、空想会想出很多绝妙的主意,但却办不成任何事情。34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。'
您可能关注的文档
- 轴对称与轴对称图形课件PPT徐.ppt
- 计量经济学课件PPT异方差.ppt
- 第二十八届全国普通高中新课程研讨会:新课程下的化学教学与高考 通用(课件PPT).ppt
- 第七章平面直角坐标系期末复习课件PPT常用课件.ppt
- 电化学基础0(26份打包) 5(课件PPT).ppt
- 电化学基础1 3(课件PPT).ppt
- 电化学复习(课件PPT).ppt
- 电化学原理与金属腐蚀与防护(课件PPT).ppt
- 生活中两种常见的有机物9(课件PPT).ppt
- 煤的综合利用――苯01(课件PPT).ppt
- 二年级1班新生家长会课件PPT.ppt
- 二元一次方程组说课课件PPT.ppt
- 人教版五年级下美术《写意蔬果》课件PPT.pptx
- 让瘪的乒乓球鼓起来课件PPT下载_冀教版四年级科学下册课件.ppt
- 苏教版三年级下册数学《认识年、月、日》课件PPT.ppt
- 小学美术课件PPT《鱼儿欣赏》.ppt
- 苏教版国标本语文五年级上册第三单元复习课件PPT.docx
- 海带中碘元素的分离及检验(课件PPT).ppt