- 599.00 KB
- 2022-04-29 14:20:55 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'3气固多相反应动力学基础
提问第三章催化反应动力学1.Langmuir方程,Temkin方程和Freundlich方程分别对应的吸附能量与覆盖度关系如何?
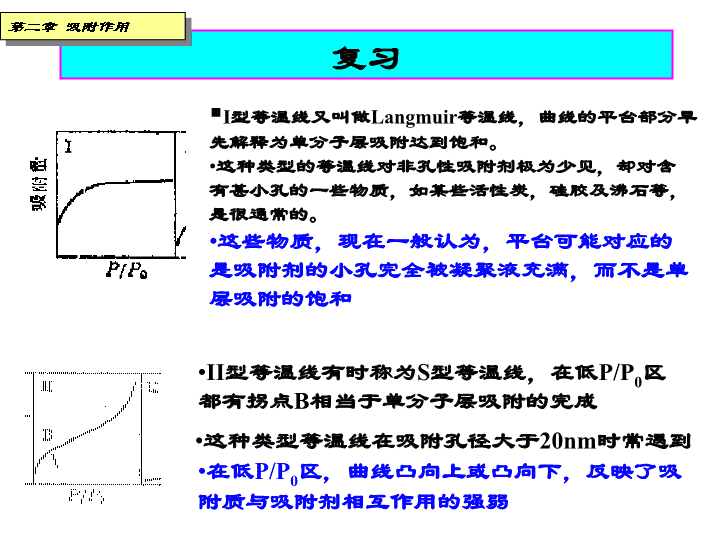
复习第二章吸附作用I型等温线又叫做Langmuir等温线,曲线的平台部分早先解释为单分子层吸附达到饱和。这种类型的等温线对非孔性吸附剂极为少见,却对含有甚小孔的一些物质,如某些活性炭,硅胶及沸石等,是很通常的。这些物质,现在一般认为,平台可能对应的是吸附剂的小孔完全被凝聚液充满,而不是单层吸附的饱和II型等温线有时称为S型等温线,在低P/P0区都有拐点B相当于单分子层吸附的完成这种类型等温线在吸附孔径大于20nm时常遇到在低P/P0区,曲线凸向上或凸向下,反映了吸附质与吸附剂相互作用的强弱
第三章气固多相催化反应动力学基础第三章催化反应动力学[教学要求]1.掌握表面质量作用定律.掌握由表面反应,吸附或脱附分别为速控步骤时的速率方程及没有速控步骤时的速率方程2.掌握两步机理模型3.了解外扩散对反应动力学的影响4.掌握反应区间的识别[教学重点]1.表面质量作用定律,由表面反应,吸附或脱附分别为速控步骤时的速率方程及没有速控步骤时的速率方程2.两步机理模型的两个假定,三个定理3.外扩散对反应动力学的影响
第三章气固多相催化反应动力学基础第三章催化反应动力学[教学难点]1.两步机理模型的两个假定,三个定理2.反应区间的识别[主要内容]1.多相催化反应过程和表面质量作用定律2.化学反应,吸附和脱附为控制步骤的动力学方程3.两步机理模型的两个假定,三个定理4.外扩散和内扩散对反应动力学的影响5.外扩散和内扩散阻滞效应的识别
研究气固多相反应动力学,从实用的角度说,为工业催化过程确定最佳生产条件,为反应器的设计打基础从理论上说,是为认识催化剂的特性提供依据,因为催化剂的动力学参量是催化剂化学特性的重要依据。这些参量是现有催化剂改进以及新型催化剂设计的依据3.1多相催化反应过程第三章催化反应动力学比如,速率常数可用以比较催化剂的活性,活化能可用以判断活性中心的异同
3.1多相催化反应过程第三章催化反应动力学气固多相催化反应的完成包括以下步骤:1.反应物自气流的主体穿过催化剂颗粒外表面上的气膜扩散到催化剂颗粒外表面2.反应物自外表面向孔内表面扩散3.在内表面上吸附成表面物种4.表面物种反应形成吸附态产物5.吸附态产物脱附6.吸附态产物,直到进入气流主体其中的吸附、脱附和表面反应是与孔内的扩散同时进行
3.1多相催化反应过程多相催化反应中的吸附、表面反应和脱附过程:表面催化过程第三章催化反应动力学
3.1多相催化反应过程第三章催化反应动力学气固多相催化反应的动力学具有以下两个特点:1.反应是在催化剂表面上的单分子层内进行,所以反应速率与反应物的表面浓度或覆盖度有关2.由于反应的多阶段性,因而反应动力学就比较复杂,尤其是受吸附与脱附的影响,常常使得总反应动力学带有吸附或脱附动力学的特征
3.2表面质量作用定律基元反应(elementaryreaction):如果一个化学反应,反应物分子在碰撞中相互直接作用直接转化为生成物的分子非基元反应亦称总包反应或简称总反应(overallreation),一个复杂反应要经过若干个基元反应才能完成,这些基元反应代表了反应所经过的途径,动力学上称为反应机理或反应历程(reationmechanism)第三章催化反应动力学
3.2表面质量作用定律经验证明基元反应的速率方程比较简单,即基元反应速率与反应物浓度(带有相应的指数)的乘积成正比,其中各浓度的指数就是反应式中各相应物质的系数。基元反应的这个规律称为质量作用定律(lawofmassaction)由挪威化学家古德贝格和瓦格(Guldberg和Weage)在前人试验的基础上提出的,“化学反应速率与反应物的有效质量成正比”,质量其原意就是浓度,质量作用定律只适用于基元反应第三章催化反应动力学
3.2表面质量作用定律例如:H2+Cl2→2HCl①Cl2+H2→2Cl·+Mr1∝k[Cl2][M·]②Cl·+H2→HCl+H·r2∝[Cl·][H2]③H·+Cl2→HCl+Cl·r3∝[H·][Cl2]④Cl·+Cl·+M→Cl2r4∝[Cl·]2[M]处理表面过程动力学的基础是表面质量作用定律。由质量作用定律可知:表面过程的基元反应,其反应速率r与反应物的表面浓度(即覆盖率成正比,其覆盖度指数等于相应的化学计量系数)第三章催化反应动力学
3.2表面质量作用定律例如A与B之间的表面反应aA+bB→产物其正向反应的速率表示为:(-r=kθAaθBb)式中k—正向反应速率常数θ值在试验技术中还无法直接得到,为了得到θ值必须借助于一定的模型和假设,最简单且最广泛的是langmuir模型,利用langmuir方程把θ值表示为反应压力,然后与实验数据关联。第三章催化反应动力学
1.速率方程与动力学的参数3.3理想吸附层的速率方程第三章催化反应动力学表示反应速率与作用物(包括反应物、产物及添加物)分压(或浓度)关系的函数称速率方程,它可以写成其中带有“,”的表示产物,带有“,,”表示添加物以上速率方程的微分形式的速率方程,微分形式的速率方程又有幂式和双曲线式两种:幂式速率方程形式:K为速率常数,α1、α2等为级数
3.3理想吸附层的速率方程第三章催化反应动力学双曲线式方程有以下或类似的形式此式描述的是SO2的氧化,其中A,B为常数,K为反应的平衡常数基元过程一般服从Arrehnius定律其中A为指前因子,E为活化能在总包反应情况下,总反应速率常数有时在形式上遵从Arrehnius定律,此时所对应的E称为表观活化能,表观活化能是否有具体的物理意义视情况而定动力学参数包括速率常数,反应级数,指前因子和活化能等
提问第三章催化反应动力学1.Langmuir方程,Temkin方程和Freundlich方程分别对应的吸附能量与覆盖度关系如何?2.气固多相催化反应的完成一般包括几个步骤?3.表面质量作用定律的内容4.动力学参数有那些?
复习第三章催化反应动力学1.Langmuir方程,Temkin方程和Freundlich方程2.吸附速率与脱附速率3.Elovich方程4.管孝男方程吸附能量随覆盖度线性变化吸附能量随覆盖度按对数方式变化
复习第三章催化反应动力学5.气固多相催化反应的完成一般包括几个步骤6.表面质量作用定律的内容7.动力学参数有那些基元反应速率与反应物浓度(带有相应的指数)的乘积成正比速率常数,反应级数,指前因子和活化能
本次课内容和要求第三章催化反应动力学1.速率控制步骤2.推导表面过程动力学方程时的两种方法(平衡浓度法和稳定浓度法3.化学反应、吸附和脱附为控制步骤的动力学方程4.不存在控制步骤的动力学方程要求掌握由表面反应,吸附或脱附分别为速控步骤时的速率方程掌握不存在控制步骤的动力学方程掌握速率控制步骤的内涵5.两步机理模型掌握两步机理模型
3.3理想吸附层的速率方程第三章催化反应动力学2.速率控制步骤催化反应一般是由许多基元反应构成的连续过程,如果其总速率由其中一步的速率决定,这一步就称为速率控制步骤速率控制步骤不一定是最慢的步骤,因为连续过程在达到定态时各步的速率相等速率控制步骤的特性在于即使有充分的作用物质存在,这步进行的速率也很慢,而其它步骤的反应在这样的条件下则可以很高的速率进行速率控制步骤是阻力最大的一步从速率控制步骤的假设我们可进行进一步的推论,在定态时速率控制步骤之外的其它各步都近似地处于平衡状态有了速率控制步骤的假定,可以使速率方程的推导大大简化
3.3理想吸附层的速率方程3.推导表面过程动力学方程时,通常有两种方法平衡浓度法:由于存在速率控制步骤过程的总速率取决于控制步骤过程的总速率取决于控制步骤速率,而其它步骤处于平衡第三章催化反应动力学稳定浓度法(定态法):当体系达到稳定状态时,表面中间态物种浓度不随时间变化
3.3.1化学反应为控制步骤的动力学方程当表面化学反应为控制步骤时,吸附和脱附必定是相对较快,在反应的任意时刻都处于平衡态。所以催化剂上反应物浓度应为吸附平衡浓度,而平衡浓度可借助化学吸附等温方程计算第三章催化反应动力学
设多相反应A+B→R由下列基元反应组成吸附:A+σ←→AσB+σ←→Bσ反应:Aσ+Bσ←→Rσ+σ脱附:Rσ←→R+σσ为吸附位,Aσ,Bσ和Rσ分别表示A,B和R的吸附态。第三章催化反应动力学3.3.1化学反应为控制步骤的动力学方程
3.3.1化学反应为控制步骤的动力学方程当表面反应为控制步骤时,即第三步的反应速率等于整个反应速率。将质量作用定律应用于三式所示表面反应即得:r=ks1θAθB-ksθRθV………………(1)其中ks1,ks—分别为表面反应的正,逆向反应速率常数θv—未覆盖度,等于1-θA-θB-θR其余三步达到平衡,所以有:kaAPAθV-kdAθA=0或θA=kAPAθV………(2)kaBPBθV-kdBθB=0或θB=kBPBθV………(3)kaRPRθV-kdRθR=0或θR=kRPRθV…………(4)式中kA=kaA/kdA,kB=kaB/kdB,kB=kaR/kdR第三章催化反应动力学
3.3.1化学反应为控制步骤的动力学方程因θA+θB+θR+θV=1故θV=1/(1+kAPA+kBPB+kRPR)…………(5)将(5)式代入(2),(3),(4)中有θA=kAPA/(1+kAPA+kBPB+kRPR)………(6)θB=kBPB/(1+kAPA+kBPB+kRPR)………(7)θR=kRPR/(1+kAPA+kBPB+kRPR)………(8)将(6),(7),(8)和(5)代入(1)式中简化有r=(kS1kAPAkAPB-kSkRPR)/(1+kAPA+kBPB+kRPR)2=K(PAPB-PR/Kp)/(1+kAPA+kBPB+kRPR)2……….(9)式中k为正反应速率常数,等于kS1kAkB,KP=kS1kAkB/kSkR为该反应的平衡常数第三章催化反应动力学
3.3.1吸附为控制步骤的动力学方程当吸附为控制步骤时,表面化学反应相对较快,因此该反应可以看成处于平衡状态,若某一组分的吸附为控制步骤的话,则其余组分认为处于平衡状态第三章催化反应动力学
3.3.2吸附为控制步骤的动力学方程假设A组分的吸附为控制步骤,反应速率等于A的吸附速率A+σ←→Aσr=kaAPAθV-kdAθA………(1)其余三个步骤达到平衡,第三步表面反应达到平衡kS1θAθB-kSθRθV=0θRθV/θAθB=kS1/kS=KS式中KS—表面反应平衡常数第二步和第四步处于平衡状态,因此:θB=kBPBθVθR=kRPRθV……(3)第三章催化反应动力学
3.3.2吸附为控制步骤的动力学方程将(3)代入(2)中可求得θA=θRθV/kSθB=kRPRθV/kSkBPB….(4)又因为θA+θB+θR+θV=1,将(3)和(4)代入得θV=1/(1+kRPR/kSPBkB+kBPB+kRPR)……………(5)将(4),(5)代入(1)中可得:r=kaAPAθV-kdAkRPRθV/kSPBkB=(kaAPA-kdAkRPR/kSPBkB)/(1+kRPR/kPPB+kBPB+kRPR)=kaA(PA-PR/kPPB)/(1+kAPR/kPPB+kBPB+kRPR)第三章催化反应动力学
3.3.3脱附为控制步骤的动力学方程Rσ←→R+σ反应速率为r=kdRθR-kaRPRθV………(4)由于前三步达到平衡,因此将θA=kAPAθV及θB=kBPBθV代入式θRθV/θAθB=KS中有θR=KSkAkBPAPBθV由于θA+θB+θR+θV=1,得θV=1/(1+kAPA+kBPB+kAkBPAPBθV)将θR及θV代入(1)得脱附为控制步骤时的反应速率方程r=(kdRkAkBPAPBkS-kaRPR)/(1+kAPA+kBPB+kskAkBPAPB)=K(PAPB+PR/kP)/(1+kAPA+kBPB+kpkRPAPB)式中K=kdRkAkBkS第三章催化反应动力学
3.3.4小结通过上述三个速率方程的建立,可以归纳出推导多相催化反应速率方程步骤如下:①假设反应的反应步骤;②确定速率控制步骤,以该反应的速率表示反应速率,并写出该步的速率方程;③非速率步骤可以认为达到平衡,写出各步骤的平衡式,将各组分的覆盖度变为各反应组分分压的函数。④根据覆盖度之和等于1,并结合(3)得到的各组分的覆盖度表达式,可将覆盖度变为各反应组分的分压的函数。⑤将(3)和(4)各组分的覆盖度及未覆盖度的表达式代入(2)中所列的速率方程化简整理后即得到该反应的速率方程第三章催化反应动力学
3.3.3不存在控制步骤的动力学方程在无控制步骤的情况下,由于各步均未达到平衡,所以就不用采用平衡浓度法,而是稳态法或稳态近似法(steadystateapproximation)由于中间产物极活泼,浓度低,寿命又短,所以近似地认为在反应达到稳定状态后,它们的浓度基本上不随时间的变化而变化,即d(Cl)/dt=0只有流动敞开的体系中,控制必要条件,有可能使反应体系中各物种的浓度保持一致,不随时间而变,在封闭体系中,由于反应物浓度的不断下降,生成物浓度不断升高,要保持中间产物的浓度不随时间而变,严格讲是不可能的,所以稳态法只是一种近似第三章催化反应动力学
3.3.4不存在控制步骤的动力学方程第三章催化反应动力学现举例说明如下如反应A→B的机理如下:中间物是Aad,根据表面质量作用定律根据稳态法假定即形成Aad的速率与Aad消失的速率相等
3.3.4不存在控制步骤的动力学方程第三章催化反应动力学因为只有A一种物质吸附,所以代θ0入上式得因各步之净速率相等,因而总反应速率用任一步之净速率表示都可以。如若用I,则有由此式看出,没有速率控制步骤时的速率方程由于包含有许多常数,因而处理上较复杂些
提问第三章催化反应动力学1.速率控制步骤的内容2.利用平衡浓度法推导多相催化反应速率方程的一般步骤3.何为稳态法?
复习利用平衡浓度法推导多相催化反应速率方程的一般步骤①假设反应的反应步骤;②确定速率控制步骤,以该反应的速率表示反应速率,并写出该步的速率方程;③非速率步骤可以认为达到平衡,写出各步骤的平衡式,将各组分的覆盖度变为各反应组分分压的函数。④根据覆盖度之和等于1,并结合(3)得到的各组分的覆盖度表达式,可将覆盖度变为各反应组分的分压的函数。⑤将(3)和(4)各组分的覆盖度及未覆盖度的表达式代入(2)中所列的速率方程化简整理后即得到该反应的速率方程第三章催化反应动力学
复习在无控制步骤的情况下,由于各步均未达到平衡,所以就不用采用平衡浓度法,而是稳态法)由于中间产物极活泼,浓度低,寿命又短,所以近似地认为在反应达到稳定状态后,它们的浓度基本上不随时间的变化而变化,即d(Cl)/dt=0只有流动敞开的体系中,控制必要条件,有可能使反应体系中各物种的浓度保持一致,不随时间而变,在封闭体系中,由于反应物浓度的不断下降,生成物浓度不断升高,要保持中间产物的浓度不随时间而变,严格讲是不可能的,所以稳态法只是一种近似第三章催化反应动力学
本次课内容和要求第三章催化反应动力学要求两步机理模型掌握两步机理模型的两个假设,三个定理外扩散对反应动力学的影响了解外扩散对反应动力学的影响
3.4两步机理模型第三章催化反应动力学实际的催化反应包括许多基元步骤与中间表面物种。若以机理出发严格推导速率方程是颇为复杂的,而且,最后得到的速率方程包含许多参数,给实验测定和机理的判断带来困难Boudart建议一个两步机理模型。其实质是从两个假设出发,利用三个定理,把任一个包含许多基元步骤的催化反应简化为一个动力学上等效的两个反应这样做就简化了动力学处理,并使得到的速率方程比较简略,其中包含的参数数目也大为减少其速率方程内在形式上与用其它复杂机理模型做很多假设得到的速率方程相同
3.4两步机理模型第三章催化反应动力学该模型的两个假设是:1.在整个反应序列中,有一步是速率控制步骤。这一假设意味着其余的步骤不重要,或在动力学上无效2.在许多表面中间物之中,有一个是最丰富的。这一假定表明其余的表面中间物种可以在动力学处理上忽略不计
3.4两步机理模型第三章催化反应动力学该模型的三个定理为:1.由若干不可逆基本步骤串联而成的催化反应中,如果最后一个基本步骤的反应物是最丰富的表面中间物,那么只有第一个和最后一个基本步骤在动力学上是有效的下面举一个例子说明这一定理以上定理的条件可以图示为因为Bad是最丰富表面中间物,速率方程中只有ka和kn出现,说明只有第一步和最后一个步在动力学上是有效的Kn一个多步过程在动力学上可以等效为一个两步过程
3.4两步机理模型第三章催化反应动力学2.由若干基元步骤串联而成的催化反应中,若有一步为不可逆,而且这一步的反应物为最丰富表面中间物,那么这步之后所有在动力学上都是无效的。该模型的三个定理为:根据定理设想以下一个机理:其中Aad为最丰富表面物种,反应在定态时有因为所以确实是在动力学上只有表面不可逆反应这一步以及其前一步的吸附为有效,表面不可逆反应后的步骤无效
3.4两步机理模型第三章催化反应动力学3.如果速控步骤的产物为最丰富表面中间物,则在其后的所有处于平衡的基本步骤可当作一个总平衡。反之,如果速控步骤的反应物为最丰富表面物种,则在此步之前的所有处于平衡的基本步骤可当作一个总平衡该模型的三个定理为:此定理描述的体系可以设想为:其中An→B1是速控步骤,则在An和A1间所有平衡可看成总平衡同理,B1和Bn间所有平衡可看成总平衡当An为最丰富表面中间物时,总平衡(4.20)成立,B1的表面浓度太小而使总平衡(4.21)不成立若B1为最丰富表面物种时,与以上情况恰好相反,(4.21)式成立,(4.20)式不成立
3.5外扩散对反应动力学的影响第三章催化反应动力学当外扩散的阻力很大,成为速控步骤,这时总过程的速率取决与外扩散的阻力,这种情况称为反应在外扩散区进行外扩散或总反应的速率表示为其中K为传质系数,s为催化剂颗粒外表面积。C0和CS分别为反应物在气流主体内和外表面的浓度因为CS很小,上式可进一步简化为在外扩散进行的反应,其动力学具有两个特点:反应物的级数与传质过程的级数一样,均为一级过程,与表面反应的级数无关所得到的表面活化能与反应物的扩散活化能相近,约在4—12KJ/mol
3.5外扩散对反应动力学的影响第三章催化反应动力学随着线速的提高,气流的湍流程度增加,从而使包围在催化剂颗粒外表面的气膜变薄,这也导致传质系数的增加,以致总反应速率加快在动力学研究中,常利用气流线速对总反应速率的这种强烈影响作为判别外扩散是否成为速率步骤的主要依据。若提高气流线速引起总反应速率明显增加,则说明反应可能发生在外扩散区
3.6内扩散对反应动力学的影响第三章催化反应动力学根据分子自身之间的碰撞、分子与孔壁间碰撞的关系,内扩散可以分为体相扩散与Knudson扩散两种方式。此外还有一种特殊的扩散----构型扩散3.6.1体相扩散又称容积扩散当固体的孔的孔径很大,气体十分浓密。气体分子间的碰撞次数远大于气体分子与孔壁的碰撞次数,这时发生的扩散即为体相扩散其中D为扩散系数,s为扩散发生的面积,dc/dX为x方向上扩散物的浓度梯度,负号表示扩散指向浓度减少的方向根据气体动力论,发生体相扩散的扩散系数D为其中v为气体分子的平均速率,λ为分子的平均自由程,它与气体压力成反比
3.6.2Knudson扩散第三章催化反应动力学当孔径很小,气体稀薄时,分子与孔壁的碰撞次数远大于分子自身的碰撞数,这时分子发生的扩散称为Knudson扩散描述这种扩散的速率仍然使用Fick第一定律,但扩散系数采用Knudson扩散Dk其中r为孔的半径,当r具有一定分布时,r取平均值,从上式看出,在发生Knudson扩散时,扩散系数与孔径成正比,与压力无关
3.6.3构型扩散第三章催化反应动力学当分子的大小与孔道相近,这时发生构型扩散.因为沸石分子筛的孔直径多在1nm以下,与分子的动力直径接近,因而在沸石分子筛中常发生这样的扩散构型扩散的速率很慢沸石内的扩散系数大约在10-11cm2/s以下,而液体容积扩散系数为10-1cm2/s,气体的Knudson扩散系数在10-3cm2/s左右扩散系数小,意味着扩散活化能高,因而构型扩散的活化能甚高于其他两种扩散
提问第三章催化反应动力学1.两步机理模型的两个假设,三个定理2.在外扩散进行的反应,其动力学的特点3.何为体相扩散与Knudson扩散
复习第三章催化反应动力学1.在整个反应序列中,有一步是速率控制步骤。这一假设意味着其余的步骤不重要,或在动力学上无效2.在许多表面中间物之中,有一个是最丰富的。这一假定表明其余的表面中间物种可以在动力学处理上忽略不计1.由若干不可逆基本步骤串联而成的催化反应中,如果最后一个基本步骤的反应物是最丰富的表面中间物,那么只有第一个和最后一个基本步骤在动力学上是有效的2.由若干基元步骤串联而成的催化反应中,若有一步为不可逆,而且这一步的反应物为最丰富表面中间物,那么这步之后所有在动力学上都是无效的3.如果速控步骤的产物为最丰富表面中间物,则在其后的所有处于平衡的基本步骤可当作一个总平衡。反之,如果速控步骤的反应物为最丰富表面物种,则在此步之前的所有处于平衡的基本步骤可当作一个总平衡
复习第三章催化反应动力学在外扩散进行的反应,其动力学具有两个特点:外扩散或总反应的速率表示为反应物的级数与传质过程的级数一样,均为一级过程,与表面反应的级数无关所得到的表面活化能与反应物的扩散活化能相近,约在4—12KJ/mol
复习第三章催化反应动力学
本次课内容和要求第三章催化反应动力学要求圆柱孔内的反应速率-----Thiele理论(主要自学)反应区间的识别掌握内外扩散阻滞效应的识别了解Thiele理论
择形催化ZSM-5系列催化剂,小孔和中孔沸石,孔道直径<1nm(1)反应物择形:只允许某些特定分子形状和结构的反应物分子进入孔道进行反应。如:ZSM-5分子筛,只允许正构烷烃或长烷基侧链选择性裂化辛烷值助剂、临氢降凝和选择性脱蜡(2)产物择形:只允许某些特定分子形状和结构的产物分子扩散出孔道。如:中孔沸石,甲苯歧化反应,只允许对二甲苯选择性生成(3)约束过渡态择形:只允许某些特定形状、大小和结构的中间过渡物生成,产生反应选择性。第三章催化反应动力学
3.6.4圆柱孔内的反应速率-----Thiele理论第三章催化反应动力学在孔外,外扩散与外表面上的反应是首尾相接的连续过程在孔内,扩散与反应同时进行反应物一方面向孔内更深处扩散,一方面在附近的孔壁上反应,但两者并非毫无关联,而是互相影响当表面反应为速控步骤时,大部分反应物有足够时间在反应之前就可以达到孔内各处催化剂的内表面对于催化反应的发生来说,都是有效的,表观反应速率几乎不受内扩散的影响,与表面反应速率接近当内扩散阻力很大,表面反应受内扩散控制,反应物在孔口内不远处的表面上很快消耗,孔内深处表面没有充分利用在孔内,由于扩散对反应的影响,致使反应物浓度沿孔的长度产生某种分布Thiele曾提出一种理论定量描述圆柱孔内的这种分布,通过这种分布可以看到扩散对反应产生怎样的影响
3.6.4圆柱孔内的反应速率-----Thiele理论第三章催化反应动力学设有一圆柱孔,半径为r,长度为2L,孔的长度变量为x,对应x处的空间反应物浓度为C,孔口处的浓度为C0,反应物自孔口向孔内扩散,扩散系数为D,与扩散同时反应物在附近的孔壁上反应。因圆柱孔左右对称,所以当x=L时,浓度梯度为零
3.6.4圆柱孔内的反应速率-----Thiele理论第三章催化反应动力学
3.6.4圆柱孔内的反应速率-----Thiele理论有效因子:表示催化剂内表面利用的程度第三章催化反应动力学表观反应速率:孔内有扩散存在时的反应速率本征反应速率:孔内无扩散存在,即相当于孔内壁完全暴露于C0下的反应速率
3.6.4圆柱孔内的反应速率-----Thiele理论Thiele(席勒)模数:表征分子在催化剂颗粒粒内扩散过程影响的无因次参数。式中de催化剂颗粒的等效直径;g催化剂的颗粒密度;Sg催化剂比表面积;kii组分的本征反应速率常数;De反应物有效扩散系数。第三章催化反应动力学
3.6.4圆柱孔内的反应速率-----Thiele理论与的关系对于不同类型的催化剂及催化反应体系有所差异,对于球形催化剂颗粒,常用关系式为:第三章催化反应动力学
提问第三章催化反应动力学1.两步机理模型的两个假设,三个定理2.在外扩散进行的反应,其动力学的特点3.何为体相扩散与Knudson扩散
复习第三章催化反应动力学1.在整个反应序列中,有一步是速率控制步骤。这一假设意味着其余的步骤不重要,或在动力学上无效2.在许多表面中间物之中,有一个是最丰富的。这一假定表明其余的表面中间物种可以在动力学处理上忽略不计1.由若干不可逆基本步骤串联而成的催化反应中,如果最后一个基本步骤的反应物是最丰富的表面中间物,那么只有第一个和最后一个基本步骤在动力学上是有效的2.由若干基元步骤串联而成的催化反应中,若有一步为不可逆,而且这一步的反应物为最丰富表面中间物,那么这步之后所有在动力学上都是无效的3.如果速控步骤的产物为最丰富表面中间物,则在其后的所有处于平衡的基本步骤可当作一个总平衡。反之,如果速控步骤的反应物为最丰富表面物种,则在此步之前的所有处于平衡的基本步骤可当作一个总平衡
复习第三章催化反应动力学在外扩散进行的反应,其动力学具有两个特点:外扩散或总反应的速率表示为反应物的级数与传质过程的级数一样,均为一级过程,与表面反应的级数无关所得到的表面活化能与反应物的扩散活化能相近,约在4—12KJ/mol
复习第三章催化反应动力学
本次课内容和要求第三章催化反应动力学要求反应区间的识别掌握内外扩散阻滞效应的识别
3.7反应区间的识别第三章催化反应动力学用动力学方法研究反应机理要确保反应在动力学区进行,此外,为了实用目的而筛选催化剂时,也要在动力学区测定活性与选择性。因此,判断反应发生的区间,估计内外扩散的影响是十分必要的3.7.1外扩散阻滞效应的识别当外扩散成为速控步骤时,通常产生以下的一些现象:(1)、随气流线速的增加,表观反应速率增加,或者,在保持空速或停留时间不变时,随气流线速的增加,反应物的转化率加大空速:单位时间内通过给定体积催化剂(或反应器)的气体(或液体)的体积数(即,m3/(m3,h)=h-1)
3.7.1外扩散阻滞效应的识别第三章催化反应动力学在实验上观察此种效应的方法如下:在几个横截面相等的反应器中,装入不同量的同一催化剂,根据催化剂装量调整加入的反应物量,以保持各反应器中物料的的空速一致在测定个反应气内的转化率后,以转化率对线速作图转化率随线速增加,说明外扩散的阻滞作用很大转化率不变,则说明外扩散阻滞作用不大(2)、随温度升高,反应物的转化率并不显著提高(3)、总过程表现为一级过程(4)、当催化剂量不变,颗粒变小时,反应物的转化率略有增加,因颗粒变小,使外表面积增大,提高了外扩散速率,由于颗粒变小引起的面积增加并显著,所以只有当颗粒的变化幅度较大时才能观察到上述效应
3.7.1外扩散阻滞效应的识别第三章催化反应动力学(5)、测定的表观活化能在4-12kJ/mol可利用以上现象作为识别反应是否在外扩散区发生的标准,若只有上述各项中的一项现象存在,对扩散的识别是不充分的其中的颗粒度效应、反应级数为一级等并不是外扩散区特有的现象,只有其中的线速效应才是关键的,为慎重计,还需要其它现象作为佐证
3.7.2内扩散阻滞效应的识别第三章催化反应动力学反应在内扩散区进行时,可观察到以下的一些现象:(1)、在催化剂量不变的情况下,随粒度的变小,表观反应速率或者转化率明显增加,因为表观反应速率与颗粒大小成反比(2)、表观活化能接近于在低温测定的真实活化能的一半(3)、表面利用系数很低(4)、增加停留时间,表观反应速率不受影响。因增加停留时间只是提高在动力学区进行的反应的速率正如对外扩散区的讨论一样,以上个项标准用于判断内扩散的效应时,应慎重,要综合考虑。其中改变粒度的实验是必须的
3.7.2内扩散阻滞效应的识别第三章催化反应动力学沸石内的外扩散是否成为控制步骤,有两个方法判别:a.测定某一反应在沸石上进行的活化能,将其与非扩散条件下测定的活化能相比即可b.改变沸石的晶粒大小观察反应速率的变化
3.7.2内外扩散阻滞效应的消除实例第三章催化反应动力学Inordertobesurethatthereactionisworkingunderachemicalregime,preliminaryexperimentswereperformedtoevaluatetheinfluenceofexternalandinternaldiffusion.Inordertoevaluatetheinfluenceofexternaldiffusion,thereactionswererunataconstantcontacttime,atdifferentvolumesofcatalystandthereforeatdifferentspacevelocities.Itwasfoundthattheexternaldiffusiondidnotplayanimportantroleatcontacttimesupto8sTheinfluenceofinternaldiffusionwasstudiedbyrunningthereactionunderthesamereactionconditionsandbychangingtheparticlesizeofthecatalyst.Itwasfoundthattheinternaldiffusiondidnotplayanimportantroleatparticlesizesmallerthan0.250mmAppliedCatalysisA:General192(2000)71–79
习题①1173K时,N2O(A)在Au上的吸附(符合langmiur吸附)分解得到下列实验数据t/s0180039006000PA/104Pa2.6671.8011.1400.721讨论N2O(A)在Au上吸附的强弱第三章催化反应动力学
习题设反应C2H6+H2CH3其反应历程可能是:(1)C2H6←→2CH3K(2)CH3+H2→CH4+HK2(3)H+C2H6→CH4+CH3K3设反应(1)为平衡状态,对H作稳态处理,试证明d[CH4]/dt=2k2k1/2[C2H6]2[H2]第三章催化反应动力学
习题光气分解的总反应为COCl2=CO+Cl2,该反应历程为(1)Cl2←→2Cl·(2)Cl+COCl2→CO+Cl3(3)Cl3←→Cl2+Cl其中(2)为控制步骤,(1),(3)为平衡状态,试证明反应速率方程为dx/dt=K[COCl2][Cl2]2第三章催化反应动力学
中医治疗内科急症的过去、现在和将来
1中医治疗内科急证本于古代中医治疗急证百年来积累了丰富的经验,并创立了系统的理论体系,上溯春秋战国以远,下迄明清,代有发展。《内经》中的“卒病”、“暴病”、“暴疾”,乃现急证之同意词,是中医典籍中最早的急证术语。同时,《内经》中记载的急性病证达数十种,如《灵枢·厥论》中“真心痛手足青至节,心痛甚,旦发夕死、夕发旦死”对急证的如此准确的描述和认只,对后世急证的辩证论治,仍具有一定的实用价值,又如《素间·至真要大论》中“急者缓之’,《素问·标本病传论》中“小大不利治其标”等急证治标求本的原则,仍然是如今治疗急证的重要原则之一。
东汉张仲景所著《伤寒杂病论》对中医急证学的建立和发展起到了承先启后的作用。如太阴脾胃虚寒,呕吐下利,用理中汤;心动悸,脉结、代,用炙甘草汤;厥阴蛔厥,用乌梅丸;太阳病误下,表证未解,热邪内迫胃肠,用葛根芩连汤;阳明燥结,急下之,用三承气汤;邪实在胸中或上脘者,用吐法,如瓜蒂散证;病邪在表,用汗法,如麻黄汤、桂枝汤、麻黄加术汤证;厥阴血虚寒厥,脉细欲绝,用当归四逆汤;少阴阳气式微,阴寒内盛,脉微细,但欲寐,厥逆下利,用四逆汤;热厥用白虎汤;黄疽用茵陈蒿汤;水气凌肺用葶苈大枣泻肺汤;水气凌心用真武汤;太阳蓄血用抵当汤;水饮用十枣汤等等。特别是伤寒证中提出一些对“卒死”者的急救方法,如药物吹鼻、鼻饲、舌下给药,温灸、保温、人工呼吸等多种抢救方法,同时也提出了对中毒的解毒措施。
晋·葛洪在《肘后备急方》中首先创用口对口吹气法沧救卒死病人的复苏术。他说:“塞两鼻孔,以芦管内其口中至咽,令人嘘之。”本书还记载了蜡疗和烧灼止血法,如以去节竹筒置于患部,灌注熔蜡和热蜂蜜进行筒灸,别具一格。本书又云:“若唯腹大,下之不去,便针脐下二寸,入数分,令水出,孔合,经腹减乃止。”这是放腹水的方法和适应症的最早记录,特别是用药物治疗急证方面有特效,如青蒿、常山治疗疟疾。汞剂治疗蛲虫病,用葎草治疗毒蛇咬伤,用羊肝治疗雀目暴盲等。还有用针与灸法治疗霍乱心腹痛,中风急证,疫病温毒,猁犬咬伤,大腹水等,对中医急救学术的发展,做出了巨大贡献。隋·巢元方在《诸病源侯论》提出了对18种内科急证抢救方法,如发斑、烦渴、狂言、呕哆、发黄、衄血、下利、二便不通、胸内痛、腹胀、喘咳、虚劳诸急,关格、齿苦痛等等。
唐代至明清诸医家对急证的贡献更为突出。如孙思邈的《备急方》中27方专供急救之用,如至今仍广用的犀角地黄汤、苇茎汤、驻车丸、黄连汤、温胆丸等均出于《千金要方》和《千金翼方》中,特别提出的是,孙氏是世界上第一位使用导尿术的医学专家。王焘在《外台秘要》记集了唐以前的多种多样的急证救治方法,包括灸法、熏吸法、吹法、导尿法、蒸法、浴法、熨法、通便法、坐药法等十余种。金·刘完素善治火热病,创立了不少辛凉有效方剂,以清热通利为主,注意润泽脾胃,成为后世温病学说治疗热病之楷模。张从正发挥了仲景汗、吐、下三法,力主攻邪,治疗急证,独树一帜,被称为“攻邪派”。
元·朱丹溪创滋阴降火法,对中风治疗,强调了内风为主,立论于湿生痰,痰生热,热生风之说,是治疗急证中风之一大创举。此外,朱氏用石碱、石螺狮治胃痛,用荷叶、百叶柳花止血,用大黄止暴痢,用附子治外脱症等。金·李杲创立“甘温除大热”法,治疗急证中多以益脾胃,升阳气为主,用补中益气治疗内伤发热,还用普济消毒饮治疗大头瘟,特别是用红花、桃仁、蒲黄、三棱、莪术等四十余种活血化瘀药,分别治疗中风、吐衄、急性脘腹痛等,至今仍用于急证治。明张介宾对急救术的应用颇重视。如救暴脱“急掐人中、速灸气海数十壮”、“吐泻不止,灸天枢、气海、中脘”,对尿漪留用鹅毛管导尿等均为治疗急证之高见。
清·王清任首创补气活血和逐瘀活血两大法,创立和修改古方30余首,以补阳还伍汤为首的补气活血法如今亦广泛应用.尤为突出的是逐瘀活血法,如血府逐瘀汤治疗胸中血瘀,膈下逐瘀汤治疗腹部血瘀,身痛逐瘀汤治疗体表血瘀,通窍活血汤治疗头部血瘀,这些多被后世医家所采用,收到特效。清·唐容川治疗血证提出了“止血、消瘀、宁血、补血”四法,为急证血证治疗打下了良好基础。叶天士揭示了温病特殊传变规律,即温病逆传之邪入心包急候,这种认识,叶氏前是均无深入认识的,并提出宜用犀角、鲜生地、连翘、郁金、石菖蒲等,并提出须用牛黄丸、至宝丹。
吴又可创三焦辨证,治温热病重在清润救肺,对后世温病学术的发展及急证治疗责献极大。王孟英创伏气新感学,特别是治疗霍乱提出伐毛、取嚏、刮焠、刺急、榻洗、熨灸诸应急之法、复详侦探、策应、纪律、守俭等要领。并他创立的新方如黄芩定乱汤、燃照汤、蚕矢汤、驾轻汤、致和汤等,为后世医家所沿用,迄今不失其临床意义。
2中医治疗内科急症如今大有创新自70年代起,中医内科急证的研究取得了可喜的成果,中风、发热、厥脱、血证、心痛、急腹证、肾绝、肺绝等多个急证治疗方面,疗效之高,令人刮目相看。
出血性中风治疗,用醒脑开窍、通腑泻热法,提高了疗效,降低了死亡率。长春中医学院附属医院任继学教授主持的出血性中风急救组用北京中医学院研制的清开灵注射液静脉注射,配合安宫牛黄丸口服或鼻饲,汤剂羚羊角、玳瑁、酒军、厚朴、枳实、炒水蛭、虫、白薇、羌活、蒲黄水煎服和肛门高位灌肠等方法,使急性出血性中风死亡率降低到22%左右。哈尔滨、上海醒脑静注射液治疗脑出血,治愈好转率为66.6%,
急证发热的急救方面,高效、速效、低毒的药有重庆的清气解毒针、退热宝口服液;南京的清热解毒四号针,上海的抗炎I号针,鹿蹄草素针;北京清开灵针、上海醒脑静针等,对流感、上感、肺炎、乙型肝炎、钩端螺旋体病、流行性出血热、急性肾盂肾炎、急性肾小球肾炎等病种的发热约五千余例的临床实验报告,疗效均满意。
急性厥脱证治疗方法,目前较为成功的是生脉针、参麦针等治疗气阴两脱;参附针、参附青针等治阳脱证,增液针、养阴针治疗液脱津伤证,升压灵针、枳实针、654-2针等行气活血化瘀,对厥脱证急救提供了新的药物。心痛急救方面出现了不少新方:如北京冠心I号方,上海丹参注射液,浙江丹参I号注射液,西苑医院川芍碱注射液,吉林心舒乐,陕西加味括篓薤白汤;还有通脉灵、冠心苏合丸、速效救心丸、宽胸丸、康心I号、冠舒注射液、心宝、心脏灵等等对心绞痛的急救和治疗提供了有效新方。
急性肾衰用通下排毒法,即用大黄粉60克冲服,有利于肾功恢复。还用解毒化瘀法,用复方大黄注射液,或用复方大黄汤灌肠给药,比口服药有了明显的疗效。急性DIC,用清瘟败毒饮合血府逐瘀汤加减治疗热甚瘀血证;用当归补血汤合血府逐瘀汤加减治疗血虚瘀血证;用独参汤合血府逐瘀汤加减治疗气虚血瘀证,疗效优异,还用丹参注射液静脉点滴,疗效更为明显。心性心衰证,用葶苈子末每日3g--6g,分3次口服,4天后心衰症状缓解,强心散每日用300mg,两天后症状缓解,强心灵注射液静注纠正心衰,作用与毒K相似,
还有呼吸衰竭、心律失常、败血症、急性出血、重症肝炎、肺炎、中毒性痢疾、肺心同病、肺心脑病、急性胆囊炎、胆道蛔虫证、胰腺炎、各种结石证等,均有较好的急救方法和新药,为今后更好的中医治疗内科急证打下了良好基础。特别是针灸(指针、点刺、叩刺、针刺)、刮痧疗法、探吐疗法、热熨疗法、含漱疗法、喷雾疗法、噙化疗法、敷法、导法、搐鼻疗法等综合疗法的应用,使中医治疗内科急证的疗效,更加提高了一层次。
3中医治疗内科急证之未来与展望几十年的奋斗,中医治疗内科急证方面取得了可喜的成果,但很多方面存在一些间题,尚需努力,把中医治疗内科急证工作推向一个更高、更新的阶段,开展中医内科急证的治疗工作和研究工作,必须发扬中医的优势和特点,还是围绕着高热、厥脱、心衰、肺衰、出血等等危证、重证、急证进行研究,关键是紧密结合临床实际,不断总结经验,反复实践,重点解决有效药物的综合急救措施无力与给药途径不佳、抢救手段落后,个个进行研究,提出高效、速效确实可行的一整套有效方法来,一个病一个病解决急救问题,这样才能把中医治疗内科急证研究工作,推向一个新阶段。
首先把中医治疗内科急证研究,看成是关系到中医能否生存之大关键问题,特别是古人发明发展起来了急证研究,不能到我们这一代人的手里丢失或停顿下来,否则这是一个最大的犯罪。第二,尽快挖掘整理和抢救当今名老中医的治疗内科急证经验、有效方剂、高超理论,加以推广,更好地为人类健康服务。第三,进行剂型改进,解决给药途径,达到高效、速效之目的。
第四,加强综合抢救措施,研究出一套疗效可靠,能够经得起验证的抢救规范。第五,每一位中医药人员要重视急证,研究急证,不断总结有效经验,认认真真地开展中医内科急证治疗研究工作,把此项工作提高到一个崭新阶段。这是中医治疗内科急证研究的当务之急。
谢谢'
您可能关注的文档
- 最新37六腑课件PPT.ppt
- 最新3L看听学第59-60课课件PPT.ppt
- 最新3《蜡烛》教学课件课件PPT.ppt
- 最新3从统计图分析数据的集中趋势课件PPT.ppt
- 最新3只拣儿童多处行PPT课件PPT课件.ppt
- 最新3拼角课件PPT.ppt
- 最新3月五行(讲)(2)课件PPT.ppt
- 最新3月五行(讲)课件PPT.ppt
- 最新3涵洞识图课件PPT.ppt
- 最新3环境对生物的影响课件PPT.ppt
- 最新3第三章-筹资决策课件PPT.ppt
- 最新3第三节--慢性肾小球肾炎病人的护理课件PPT.ppt
- 最新3第三节--慢性支气管炎、阻塞性肺气肿、肺源性心脏病病人的护理课件PPT.ppt
- 最新3脑血管病伴发的精神障碍PPT课件PPT课件.ppt
- 最新3鼻出血课件课件PPT.ppt
- 最新3鸟的天堂课件PPT.ppt
- 最新3雨的四季课件PPT.ppt
- 最新4-中医美容学—第二章第1.4节课件PPT.ppt