- 621.00 KB
- 2022-04-29 14:29:45 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'对CTD资料要求解读-原料药生产工艺与特性鉴定---经典
主要内容一、前言二、原料药生产工艺资料要求解读三、特性鉴定资料要求解读四、结语
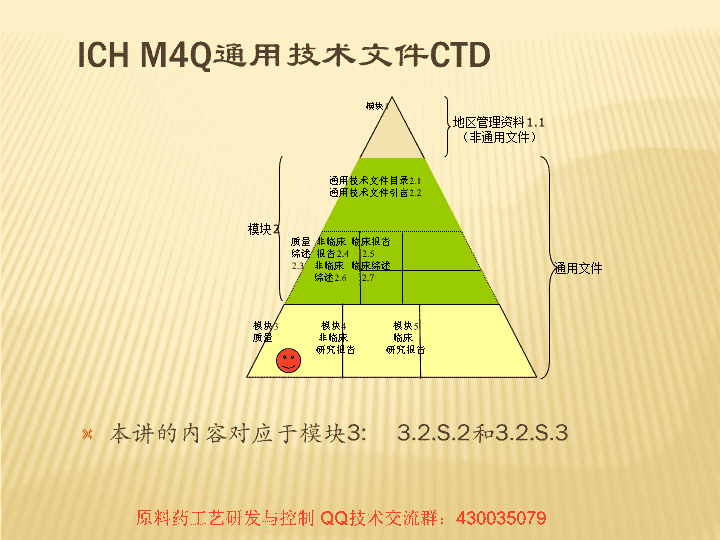
模块1通用技术文件目录2.1通用技术文件引言2.2质量非临床临床报告综述报告2.42.52.3非临床临床综述综述2.62.7模块3模块4模块5质量非临床临床研究报告研究报告ICHM4Q通用技术文件CTD本讲的内容对应于模块3:3.2.S.2和3.2.S.3地区管理资料1.1(非通用文件)模块2通用文件
二、原料药生产工艺资料要求解读3.2.S.2生产信息3.2.S.2.1生产商3.2.S.2.2生产工艺和过程控制3.2.S.2.3物料控制3.2.S.2.4关键步骤和中间体的控制3.2.S.2.5工艺验证和评价3.2.S.2.6生产工艺的开发
3.2.S.2.1生产商内容:原料药生产商的信息以及生产场所的信息关注:生产场所与生产许可证上的地址要一致,并与生产现场检查的地址一致地址系生产活动的实施场所,而非公司总部地址如关键起始原料为外购,必要时,将对起始原料生产商进行延伸检查,需明确外购起始原料的生产商地址3.2.S.2生产信息
3.2.S.2.2生产工艺和过程控制(1)工艺流程图:按合成步骤提供工艺流程图(2)工艺描述:按工艺流程来描述工艺操作(3)生产设备:提供主要和特殊设备的型号及技术参数(4)批量范围:说明大生产的拟定批量范围前言3.2.S.2生产信息
(1)工艺流程图(Flowchart)应包括如下信息:起始原料、中间体、终产品的化学名称或代号、化学结构式、分子式和分子量,如有立体化学结构,应标明立体构型各步骤所用溶剂、催化剂、试剂等各步骤的操作参数(如温度、时间、压力、pH等)各关键步骤,过程控制点3.2.S.2生产信息
(2)工艺描述以注册批为代表,列明各反应物料的投料量、工艺参数及收率范围,明确关键生产步骤、关键工艺参数以及中间体的质控指标关注:工艺描述中给出的工艺应与生产现场检查的工艺一致,并与生产工艺规程和批生产记录的样稿一致工艺描述应准确,详略程度应能使本专业的技术人员根据申报的生产工艺可以完整地重复生产过程,并制得符合标准的产品前言3.2.S.2生产信息
举例:某药物生产需经过5步反应,工艺描述如下:步骤1:***的烃基化反应(或***的制备)前言3.2.S.2生产信息成分用量SM175kg(***mol)溴乙酸叔丁酯60L(***mol)ZnCl21kg二氯甲烷200L
举例(续)500L的反应釜(重要设备需说明材质和型号)中加入200L二氯甲烷,搅拌条件下加入75kg的SM1和60L的溴乙酸叔丁酯,再加入1kg的ZnCl2,50~60℃条件下搅拌反应2~3h,锚式搅拌浆,转速200rpm;HPLC法检测反应终点,当起始原料SM1的剩余量小于1%时视为反应完全。反映完毕,反应液在90℃条件下浓缩,冷却析晶,得到90kg中间体1,收率范围为***%~***%。经检验,中间体1质量符合其内控标准后,用于下步反应。前言3.2.S.2生产信息
(2)工艺描述(续)返工(Reprocessing)工艺过程中对不符合质量标准的中间体/终产物采用相同的生产工艺进行的重复操作关注:如大部分批次均需返工,则应将其列入标准生产工艺如将未反应的物料重新引入生产工艺步骤并重复化学反应,则需先进行仔细评估以确保中间体、终产物的质量不受可能形成的副产物和反应过度产物的负面影响注意概念:ReprocessingvsReworking前言3.2.S.2生产信息
(2)工艺描述(续)返工操作应在申报资料总予以描述例如:*终产品精制1~2遍,使之符合放行标准。*重复精馏工序,使中间体2符合其内控标准。前言3.2.S.2生产信息
(3)生产设备列表给出主要和特殊设备的型号及技术参数关注:需与生产现场检查所用工艺信息表中的信息一致(4)批量范围说明大生产的拟定批量范围关注:注册批和拟定大生产批之间批量的差距例如:某药物注册批量为40kg,商业化生产每批次的拟定批量范围为30kg~130kg。前言3.2.S.2生产信息
3.2.S.2.3物料控制按照工艺流程图中的工序,列表给出生产中用到的所有物料(如起始物料、反应试剂、溶剂、催化剂等),并说明所使用的步骤——明确标准(项目、检测方法和限度)——提供必要的方法学验证资料物料控制信息表前言3.2.S.2生产信息物料名称质量标准生产商使用步骤AUSP31***步骤1BCP2010版***步骤1C企业标准***步骤2D……***步骤3
3.2.S.2.3物料控制(续)起始原料(SM)——GMP监管的起点起始原料的质量直接关系到终产品质量和工艺稳定性终产品中杂质种类复杂,杂质含量超标后续反应的投料比例不符,副产物增加,收率降低反应异常,甚至无法进行,如:-催化毒物的存在使催化剂中毒-水分含量高使格式试剂不能正常反应-……前言3.2.S.2生产信息
起始原料(续)建立合理的质控标准,重点关注杂质控制,保证不同批次起始原料的质量一致性起始原料的质量控制——项目的针对性-起始原料中的杂质可能被带入终产品,如芳香化合物的位置异构体,需设置位置异构体杂质控制项目-手性起始原料,需设置光学纯度控制项目-对于必须在干燥条件下反应,需对水分进行严格控制-……前言3.2.S.2生产信息
起始原料(续)起始原料的质控标准——限度的合理性三批SM的含量实测结果皆是在98%以上,标准限度定位95%,依据不充分。某SM中含有10%的杂质A,研究结果显示其存在对后续反应无影响,终产品中无杂质A及其他>0.1%的杂质存在,SM标准中杂质A的限度定为<10%。关注:起始原料中杂质的去向及对终产品的影响前言3.2.S.2生产信息
起始原料(续)从SM到终产品,如果申报的工艺步骤较短、SM的结构复杂,监管机构可能要求申请人:固定SM的来源,提供其生产工艺和过程控制结合其生产工艺制定针对性的质控标准,提供方法学验证资料,以及检验报告,重点关注杂质的情况提供对SM生产商的审计报告,并对生产厂进行延伸检查前言3.2.S.2生产信息
3.2.S.2.4关键步骤和中间体的控制关键(Critical):为保证药品符合要求而确立的必须被控制在预先确定的标准范围之内的工艺步骤、工艺条件、试验要求或其他有关的参数或项目。——ICHQ7A关键步骤及关键工艺参数对种产品的质量有重要影响,关键工艺参数微小的改变即可对后续工艺和产品质量产生明显影响。前言3.2.S.2生产信息
3.2.S.2.4关键步骤和中间体的控制关键步骤:在3.2.S.2.2生产工艺和过程控制中需提供全部生产工艺(关键/非关键),本模块重点阐述关键工艺步骤判出所有关键步骤(包括终产品的精制、纯化工艺步骤等)及其工艺参数的控制范围提供确定关键步骤/关键工艺参数控制范围的依据关键步骤/关键工艺参数控制范围的确定应在3.2.S.2.6生产工艺开发阶段获取信息前言3.2.S.2生产信息
关键步骤的界定(1)依据经验尖顶型反应:对环境、条件要求苛刻,可能为关键步骤,需重点考察其工艺参数、规模放大对参数的影响例如:付-克反应、格氏反应需严格控制环境、设备、试剂的干燥情况前言3.2.S.2生产信息
关键步骤的界定(续)(2)依据前期(小试/中试)研究的结果水解步骤:pH值、水解温度、水解时间对重均分子量有重大影响羟乙基化步骤:投料比、反应时间对提取度、C2/C6比值有直接影响关键步骤界定:水解步骤和羟乙基化步骤为关键步骤,需对以上步骤和以上参数严格控制前言3.2.S.2生产信息淀粉水解水解产物羟乙基化羟乙基淀粉
关键步骤的界定(续)(3)依据惯例越靠近终产品的步骤,对原料药质量的影响越大终产品的精制、纯化工艺步骤:直接影响原料药的有关物质、残留溶剂、晶型、溶剂化物等粉碎步骤:粉碎模式、粉碎时间等对原料药粒度控制的影响前言3.2.S.2生产信息
3.2.S.2.4关键步骤和中间体控制中间体控制:列出分离中间体的质量控制标准,包括项目、方法和限度,并提供必要的方法学验证资料及时纠偏:保证生产过程的一致性,及时纠正过程中出现的各种偏差质控前移:保证终产品的质量一致性,有利于精制等后处理操作关注:各中间体中的杂质溯源和杂质去向前言3.2.S.2生产信息
3.2.S.2.4关键步骤和中间体控制评价要点关键步骤是否已界定,是否提供了支持性数据,关键步骤的界定是否合理是否制定了各中间体、粗品的质控标准,质控标准是否合适所有关键的操作参数、过程检测、中间体及粗品的质量关键步骤的控制是否与相关批(例如工艺验证批等)的批生产记录一致前言3.2.S.2生产信息
3.2.S.2.4关键步骤和中间体控制关注:关键步骤和关键工艺参数的获得是基于生产工艺研究的结果,也是工艺验证工作的核心内容。这些工艺参数(范围)确定后,在生产过程中应严格控制,以保证产品质量,不得进行擅自修改和变更药品上市后,关键工艺参数的变更应进行相关的验证性研究,并进行补充申请的申报和审批,获得批准后方可进行变更前言3.2.S.2生产信息
3.2.S.2.5工艺验证和评价工艺验证(ProcessValidation)系统论证药品的生产步骤、过程、设备、人员等因素,保证生产工艺能够达到预定的效果,并保证药品生产的一致性和连续性所进行的研究工作。目的:确保批准工艺在生产线能够连续性的生产出质量一致的药品,实现生产过程的最优化根据研究结果确定各关键工艺参数在实际生产时的控制范围前言3.2.S.2生产信息
3.2.S.2.5工艺验证和评价(续)目前要求:无菌原料药:应提供工艺验证方案和验证报告其他原料药:同上,或提供工艺验证方案和批生产记录样稿,同时提交上市后对前三批商业生产批验证承诺书提示:验证方案、验证报告、批生产记录等应有编号及版本号,且由合适人员(如QA、QC质量及生产负责人等)签署前言3.2.S.2生产信息
3.2.S.2.5工艺验证和评价(续)工艺验证方案的内容:工艺设备关键工艺参数或运行参数的范围产品特征取样计划应收集的试验数据验证试验的次数验证结果认可标准……前言3.2.S.2生产信息
3.2.S.2.5工艺验证和评价(续)由于前三批商业生产批的规模与注册批的规模可能有所不同,因而对于其他原料药,验证方案的工艺参数是基于前期研究的经验确定,但这些工艺参数仍需符合生产工艺和过程控制(3.2.S.2.2)中的参数范围。如果研究显示这些参数与规模无关,则可直接放大;反之,则需对该步骤进行进一步研究,获得研究数据。前言3.2.S.2生产信息
3.2.S.2.5工艺验证和评价(续)关注:验证方案是否包括了对所有关键工艺的控制要求;验证中是否对所有关键工艺参数进行了控制和监测验证方案/验证报告中的工艺参数与申报资料中其他部分描述的工艺参数是否一致验证报告中是否对背离方案和异常现象进行了分析评估,分析是否合理验证结果是否证明了原料药质量符合质量标准的要求,杂质谱是否与历史数据具有可比性或更优前言3.2.S.2生产信息
3.2.S.2.6生产工艺的开发提供工艺路线的选择依据(文献依据、自行设计)提供详细的研究资料(研究方法、结果、结论),以说明关键步骤确定的合理性以及工艺参数控制范围的合理性详细说明在工艺开发过程中生产工艺的主要变化(批量、设备、工艺参数以及工艺路线等的变化)及相关支持性验证研究资料前言3.2.S.2生产信息
3.2.S.2.6生产工艺的开发(续)关注:应为工艺优化、工艺验证和工艺控制要求提供依据,尤其是关键工艺参数的确定从小试中试大生产的规模,以及规模发生变更所带来的各种参数的变化情况:参数发生变更一定要详细说明,并说明变更的原因每个关键参数都要进行规模相关的研究,最终确定的参数应有充分的依据前言3.2.S.2生产信息
3.2.S.2.6生产工艺的开发工艺研究数据总表:关注:工业开发过程总每个批次的杂质情况,为终产品质量标准的确定提供依据前言3.2.S.2生产信息批号试制日期试制地点试制目的/样品用途批量收率工艺样品质量含量杂质性状等
小结:强调工艺研究各个模块之间的相互关联和全过程控制,通过生产工艺开发,了解物料性质,优化生产工艺,界定关键步骤及其工艺参数范围;通过工艺验证进一步确认能持续生产出符合质量要求药品的生产工艺。强调对工艺过程的杂质研究和杂质控制,起始原料、中间体、关键步骤、工艺验证等各个环节,都要对杂质进行溯源,并分析杂质去向,依据杂质的变化情况和杂质的控制情况制定相应的质量标准。构建生产过程控制药品质量的药品质量控制体系前言3.2.S.2生产信息
三、特性鉴定资料要求解读3.2.S.3特性鉴定3.2.S.3.1结构和理化性质(1)结构确证(2)理化性质3.2.S.3.2杂质
3.2.S.3.1结构和理化性质(1)结构确证结合合成路线以及各种结构确证手段对产品的结构进行解析,如可能含有立体结构、结晶水/结晶溶剂或者多晶型问题要详细说明提供结构确证用样品的精制方法、纯度、批号,如用到对照品,应说明对照品来源、纯度及批号;提供具体的研究数据和图谱进行解析参照SFDA:化学药物原料药制备和结构确证研究技术指导原则前言3.2.S.3特性鉴定
3.2.S.3.1结构和理化性质(2)理化性质提供详细的理化性质信息,包括:性状;熔点或沸点,比旋度,溶解性,吸湿性等,将用于制剂生产的屋里形态(如多晶型、溶剂化物或水合物),粒度等重点关注与制剂性能及生产相关的关键理化性质,提供研究方法和结果,如:溶解性(不同溶剂、不同pH)、晶型、粒度、吸湿性等ICHQ6ASepecifications:testproceduresandacceptancecriteriafornewdrugsubstancesandnewdrugproducts:chemcalsubstances前言3.2.S.3特性鉴定
3.2.S.3.2杂质列出产品中可能含有的杂质(有机杂质、无机杂质、残留溶剂和催化剂),分析杂质的来源,提供控制限度。对于已知杂质需提供结构确证资料(要求同原料药)。杂质情况分析表前言3.2.S.3特性鉴定杂质名称杂质结构杂质来源杂质控制限度是否定入质量标准
3.2.S.3.2杂质(续)杂质包括有机杂质、无机杂质、残留溶剂和催化剂,贯穿于工艺研究、质量研究、稳定性研究、药理毒理及临床研究的各个环节杂质研究是生产工艺研究的重要内容,需结合原料药的生产工艺对杂质进行分析和控制,贯穿于整个生产过程中工艺过程中不控制杂质,则给终产品中的杂质去除和杂质控制带来很大困难;工艺过程中不分析杂质,则会加大质量研究部分的杂质分析和杂质控制的难度前言3.2.S.3特性鉴定
3.2.S.3.2杂质(续)本讲主要对工艺杂质(起始原料、中间体、副产物等相关物质)进行杂质溯源和杂质谱分析,降解产物、残留溶剂等其它杂质的分析和方法学验证研究将在质量研究部分重点讲述。前言3.2.S.3特性鉴定
3.2.S.3.2杂质(续)杂质谱分析——分析杂质的来源对原料药在合成、精制和贮存过程中可能产生的包括实际存在的和潜在的杂质进行分析起始原料中引入合成中未反应完全的反应物中间体副产物:工艺研究中需密切关注从哪一步引入副产物的相关产物(进一步反应产物)降解产物……前言3.2.S.3特性鉴定
3.2.S.3.2杂质(续)杂质谱分析的意义:是建立可靠的杂质检查方法的重要基础,是保证药品中的杂质得以全面、有效控制的前提从理论上推导出杂质结构,便于杂质定性和文献比对为杂质对照品的获得提供信息,便于杂质对照品的合成或外购前言3.2.S.3特性鉴定
3.2.S.3.2杂质(续)杂质谱分析的方法结合起始原料的合成工艺分析其中的杂质根据工艺路线推测可能的副反应产物根据副产物的结构推测副产物的后续产物其他:副产物与中产品的进一步反应产物?不同步骤的副产物之间的相互反应产物?前言3.2.S.3特性鉴定
小结:每一种原料药都应有杂质谱,用以描述常规产品中可能存在的已确认和未确认的杂质情况(有机杂质、无机杂质、残留溶剂、催化剂)原料药杂质情况一般与原料药的生产工艺和所用起始原料有关,通过对起始原料和工艺过程的系统分析,全面了解产品中的杂质情况在杂质谱分析的基础上,针对性的建立有关物质检查方法,以有效控制产品质量前言3.2.S.3特性鉴定
四、结语附件2格式→CTD格式:格式服务于内容,以有效落实全面质量控制的理念;但无论采用何种格式,技术要求一致生产信息部分强调了生产过程中对影响药品质量的各种因素的有效控制,充分体现了过程控制药品质量的理念特性鉴定部分突出了对工艺杂质、降解产物的系统研究和控制,以及对可能影响制剂生产和制剂特性的关键理化性质的研究和控制
谢谢!
脑积水乌兰察布市中心医院神经外科邢玉宝
概念脑积水(Hydrocephalus)不是一种病,它是由多种病因引起的一种病理结果。脑积水是由于颅脑疾患使得脑脊液分泌过多或(和)循环、吸收障碍而致颅内脑脊液量增加,脑室系统扩大或(和)蛛网膜下腔扩大的一种病症,通常以脑脊液循环通路梗阻和吸收不良较为多见,而分泌过多者较为少见。广义的脑积水亦应包括蛛网膜下腔积液、硬膜下积液等。
脑脊液cerebralspinalfluid(CSF)是充满于脑室系统、脊髓中央管和蛛网膜下隙内的无色透明液体,属于无功能细胞外液,内含无机离子、葡萄糖和少量蛋白,细胞很少,主要为单核细胞和淋巴细胞,其功能相当于外周组织中的淋巴,对中枢神经系统起缓冲、保护、营养、运输代谢产物以及维持正常颅内压的作用。脑脊液总量在成人约150ml,产生的速0.3ml/min,日分泌量为在400~500ml。它处于不断地产生、循行和回流的平衡状态。
分类依据病理分类⑴梗阻性脑积水:梗阻性脑积水又称非交通性脑积水或称脑室内型梗阻性脑积水,是指病变位于脑室系统内或附近,阻塞脑室系统脑脊液循环而形成。即第四室出口以上部位发生阻塞造成的脑积水,是脑积水中最为常见的一种。常见于蛛网膜囊肿,导水管闭锁或狭窄,正中孔或室间孔发育不良。Chiari畸形,颅咽管瘤等。
分类⑵交通性脑积水:交通性脑积水是由于脑室外脑脊液循环通路受阻或吸收障碍所致的脑积水,也有产生过多的脑脊液而致脑积水(乳头状瘤)。
分类依据病因分类⑴创伤性脑积水;⑵耳源性脑积水;⑶感染性脑积水;⑷占位性脑积水;⑸出血性脑积水。依据发病速度⑴急性脑积水;⑵慢性脑积水;⑶正常颅内压脑积水;⑷静止性脑积水。依据年龄分类:婴幼儿脑积水:婴幼儿期脑脊液循环通路受阻,吸收障碍或分泌过多使脑脊液积聚脑室系统和蛛网膜下腔,致脑室或蛛网膜下腔扩大。形成头颅扩大、颅内压增高、脑功能障碍。其发生率为3‰至5‰。年长儿童及成人脑积水。
发病原因脑积水可由多种原因引起,常见的有颅内炎症、脑血管畸形、脑外伤、各种内源性或外源性神经毒素、缺氧、水和电解质紊乱、酸中毒、肝肾功能衰竭等都可通过不同机制造成液体在脑组织内积聚而成。
发病机制脑脊液循环通道受阻⑴先天畸形:可能与父母接触了某些化学放射物质,孕早期发热、服用某些药物、胎位异常、羊水过多等有关。较多见的畸形有脊柱裂、中脑导水管狭窄等。
⑵感染:如化脓性脑膜炎、结核性脑膜炎、脑室炎等,由于增生的纤维组织阻塞了脑脊液的循环孔道,特别多见于第四脑室孔及脑底部的蛛网膜下腔粘连而发生脑积水。⑶出血:颅内出血后纤维增生可引起脑积水,产伤后颅内出血吸收不良,也是新生儿脑积水的常见原因,且往往易被忽视。脑外伤后蛛网膜下腔出血致蛛网膜粘连而发生脑积水。⑷肿瘤:颅内肿瘤可阻塞脑脊液循环通路的任何一部分,较多见于第四脑室附近,新生儿期难得遇见肿瘤,以后可发生神经胶质瘤,脑室脉络丛乳头状瘤及室管膜瘤、神经母细胞瘤。
脑脊液分泌过多先天性脑积水的病因学说较多,公认的学说则为侧脑室脉络丛增生,分泌旺盛,引起脑室脉络丛分泌脑脊液功能紊乱,从而发生脑积水。
脑脊液吸收障碍如胎儿期脑膜炎等所致脑脊液吸收障碍而发生脑积水。
病理及病理生理脑积水形成之后,脑脊液循环通路受阻而引起脑室系统由于脑脊液的积聚而扩张,脑室进一步扩大,可使脑脊液进入室周组织而引起白质水肿,这时即使行脑脊液分流术,使脑室恢复到正常大小,白质水肿已不能恢复,若脑积水进一步发展,大脑皮层受压变薄,则可继发脑萎缩。第三脑室的扩张可使下丘脑受压而萎缩,中脑受压则使眼球垂直运动发生障碍,出现临床所见的“落日征”。脑积水引起的颅内压增高可使双侧横窦受压,使注入两侧颈内静脉的血流受阻,因而可出现代偿性颈外静脉系统的血液回流增加,继发头皮静脉怒张。
临床表现典型症状为头痛、呕吐、视力模糊,视神经乳头肿偶伴复视,眩晕及癫痫发作。
婴幼儿脑积水临床特征⑴头围增大婴儿出生后数周或数月内头颅进行性增大,前囟也随之扩大和膨隆。头颅与躯干的生长比例失调,如头颅过大过重而垂落在胸前,头颅与脸面不相称,头大面小,前额突出,下颌尖细,颅骨菲薄,同时还伴有浅静脉怒张,头皮有光泽。⑵前囟扩大、张力增高竖抱患儿且安静时,囟门仍呈膨隆状而不凹陷,也看不到正常搏动时则表示颅内压增高。
⑶破罐音对脑积水患儿进行头部叩诊时(额颞顶叶交界处),其声如同叩破罐或熟透的西瓜样。⑷“落日目”现象脑积水的进一步发展,压迫中脑顶盖部或由于脑干的轴性移位,使婴儿的眼球不能上视,出现所谓的“落日目”征。⑸头颅透照性重度脑积水若脑组织(皮质、白质)厚度不足1cm时,用强光手电筒直接接触头皮,如透照有亮度则为阳性,如正常脑组织则为阴性(无亮度)。
年长儿童及成人脑积水的临床特征临床一般表现为头痛、恶心、呕吐、视力障碍等。
诊断临床特征成人慢性梗阻性脑积水常表现为间断性头痛、头胀、头沉、头晕、耳鸣耳堵、视力下降、下肢无力;婴幼儿梗阻性脑积水多见头颅增大,前囟紧张饱满,颅缝开裂,头皮静脉怒张,落日目,眼球震颤,斜视,可伴有语言、运动功能障碍,抽搐,智力低下。
影像学特征CT征象是脑室扩大,中度与重度脑积水通过一次扫描即可确诊,轻度者需多次观察确有脑室进行性扩大才能诊断。梗阻性脑积水在CT上有3个征象:①额角上外侧部圆形扩大;②颞角扩大;③脑室周围低密度。
治疗手术治疗:解除梗阻手术(病因治疗):病因治疗应成为治疗脑积水的首选方法。对阻塞性脑积水来说,解除梗阻是最理想的方法。如室间孔穿通术、导水管重建术、第四脑室囊肿造瘘术、脑室内肿瘤切除术、第三脑室底造瘘术、枕大孔减压术等。
脑脊液分流术:①脑室与脑池分流,如:侧脑室与枕大池分流术;②脑室体腔分流,如:脑室(或脑池)腹腔分流术;③脑室与输尿管分流术;④脑脊液引入心血管系统,如:脑室心房分流术
谢谢'
您可能关注的文档
- 最新宿舍改造方案课件PPT.ppt
- 最新宿舍标准教程课件PPT.ppt
- 最新宾语从句讲解课件PPT课件.ppt
- 最新宾语从句专项练习PPT课件PPT课件.ppt
- 最新密铺课件PPT课件.ppt
- 最新寓言二则揠苗助长课件课件PPT.ppt
- 最新富集在海水中的元素氯课件PPT.ppt
- 最新富贵不能淫贫贱不能移修改课件PPT.ppt
- 最新富贵不能淫-课件PPT课件.ppt
- 最新寨卡病毒病防控摘要课件PPT.ppt
- 最新寡头市场模板课件PPT.ppt
- 最新寡人之于国也经典课件PPT课件.ppt
- 最新寡人之于国也优秀获奖课件PPT.ppt
- 最新察找原因鱼骨图柏拉图直方图ff重点课件PPT.ppt
- 最新寓言故事中的“对比”群文阅读课件PPT.ppt
- 最新对于幸福的定义-英文PPT课件PPT.ppt
- 最新对数与对数运算课件PPT.ppt
- 最新对弧长的曲线积分课件PPT.ppt