- 2.82 MB
- 2022-04-29 14:42:43 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'第15章-氧族元素
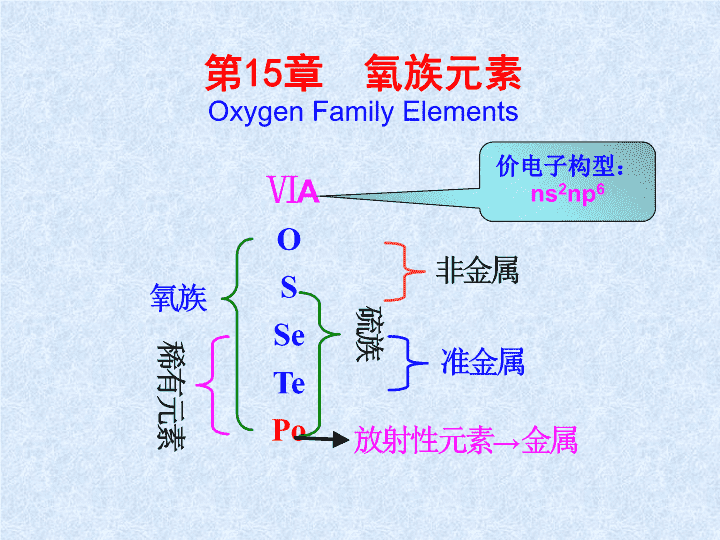
第15章氧族元素OxygenFamilyElements价电子构型:ns2np6
§15—1氧族元素的通性1—1氧族存在
氧族元素的电势图低价硫化合物不论在酸性还是在碱性溶液中都是强还原剂酸介质中,过硫酸盐是强氧化剂
§15—2氧及其化合物2—1氧气单质一、成键特征夺取两个电子形成O2-共用两个电子形成两个单键-O-形成一个双键O=O2s22px22py12pz1接受电子对形成配键→O
1.以氧原子为基础⑴.O+2e→O2-,离子型:Na2O、MgO⑵.-O-两个共价单键:H2O、Cl2O,O采取sp3杂化,V型⑶.重键倾向很强:=O,H2C=O,(H2N)2C=O(尿素)⑷.共价三键,CO、NO、O2⑸.R-O-R、=O:,均由两对孤对电子,形成配合物,H3O+等。⑹.配位键:①受体:R≡O,d-pπ,“酰氧”,含氧酸。②配位原子:氧原子上有孤电子对,可给出形成水合物,醚合物,醇合物和氢键等。
2.O3可得一电子成O3-,离子性臭氧化物。Na、K、Rb、Cs,MO3.3.O2+2e→O22-或-O-O-,过氧化物,离子型:Na2O2、BaO2;共价性:H2O2。4.O2+e→O2-,离子型超氧化物:KO2等。5.O2-e→O2+,生成二氧基O2+阳离子化合物。O2+Pt+3F2=O2+[PtF6]-还有:O2[AsF6]、O2[SbF6]、O2[BF4]
二、基本性质、制备和应用2O(1s22s22p4)→O2[KK(σ2s)2(σ2s*)2(σ2px*)2(π2p)4(π2p*)2]氧气是无色无味,90K:淡蓝色液体,54K:淡蓝色固体。非极性分子,293K时100cm3水中溶解3.08cm3。水中:存在O2·H2O、O2·2H2O。因单电子而呈顺磁性制法:工业上是通过空气的低温分馏来制备氧气;实验室主要利用氯酸钾分解来制备。应用:氧作为氧化剂有着广泛的应用,如炼钢工业中的吹氧、切割焊接中的氢氧焰、氧炔焰、航天器中的高能燃料氧化剂、医疗中急救等。
*三.单线态氧及其性质量子力学中用公式(2S+1)来表示原子光谱中的谱线条数。如正旋为1/2,逆旋为-1/2,当两个电子都为顺旋则2S+1=3(即三线态),若一个为顺旋一个为逆旋则2S+1=1(即单线态或激发态)这种状态是在一定特殊条件形成的(如:氯气通入NaOH中产生红色荧光)。电子态2p*轨道电子排布符号高出基态的能量(kJ/mol)第二激发态第一激发态基 态↑↓↑↓__↑↑1g+(1O2)1g(1O2)3g-(2O2)154.892.0
2—2氧化物1.酸性氧化物:大多数非金属氧化物与某些高价金属氧化物。2.碱性氧化物:大多数金属氧化物氧化物显碱性。3.两性氧化物:某些金属氧化物(如Al2O3、ZnO、Cr2O3、Ga2O3)和少数非金属氧化物(As4O6、Sb4O6、TeO2)显两性。4.中性氧化物:它们既不与酸,也不与碱作用,例如CO、N2O等。5.复杂氧化物:例如Fe3O4、Pb2O3等,它们分别由其低价氧化物和高价氧化物混合组成。
6.规律⑴.同周期各元素最高氧化态从左到右碱性→两性→酸性:Na2OMgOAl2O3SiO2P4O10SO3Cl2O7碱性两性酸性⑵.相同氧化态的同族元素的氧化物从上到下碱性增强:N2O3P4O6As4O6Sb4O6Bi2O3酸性两性碱性⑶.同元素不同氧化态的氧化物,随氧化态的升高酸性增强:As4O6两性PbO碱性As4O10酸性PbO2两性⑷.键型:离子型:碱金属、碱土金属。共价型:Ag2O、SnO、Mn2O7。过渡性:其他。
选H2O(两性)做标准,以各氧化物与其反应的ΔrGθ值来判断氧化物的酸碱性之相对强弱:Na2O(s)+H2O(l)=2NaOH(s) ΔrGθ=-148kJ·mol-1MgO(s)+H2O(l)=Mg(OH)2(s)ΔrGθ=-27kJ·mol-11/3Al2O3(s)+H2O(l)=2/3Al(OH)3(s)ΔrGθ=7kJ·mol-1△rG0值依次增大,碱性减弱。1/3P2O5(s)+H2O(l)=2/3H3PO4(s)ΔrGθ=-59kJ·mol-1SO3(l)+H2O(l)=H2SO4(l)ΔrGθ=-70kJ·mol-1Cl2O7(g)+H2O(l)=2HClO4(l)ΔrGθ=-329kJ·mol-1△rG0值依次减小,酸性增强。
2—3臭氧离地面20-40km处有臭氧层,0.2ppm。1.制备:大气层中O3的生成与消去地面大气层含量极微,仅0.001ppm由于上述反应,使太阳光的大部分紫外线被吸收,从而使地面的生物免遭紫外线的伤害。人类应当如何保护臭氧层?氧气在紫外线的作用下发生如下平衡:O2+hvO+OO+O2=O3O3+hvO2+O
破坏臭氧层的污染气体主要有:NO2、CO、H2S、SO2...氟氯烃俗名氟里昂如CFCl3CF2Cl2这些物质在臭氧层中能产生单原子自由基,并与臭氧分子反应:保卫可爱家园,减少毒气排放!!!CF2Cl2+hvCF2Cl·+Cl·NO2+hvNO+OCl·+O3→ClO·+O2ClO·+O→Cl·+O2NO+O3→NO2+O2NO2+O→NO+O2想一想:为什么说保护臭氧层就是保护人类自已?
南极臭氧洞南极地区出现了全球臭氧量最低值,大约低于全球臭氧平均值的30%~40%,相对于其他地区来说,就像是一个洞。“南极臭氧洞”只在南极地区的春季(9~11月)出现,持续1个月左右。图中展示了1979年10月~1992年10月,“南极臭氧洞”大小的变化。
实验室里制备臭氧在实验室里制备臭氧主要靠紫外光(<185nm照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,含臭氧可达3~10%。臭氧发生器由两根玻璃套管所组成的,中间玻璃管内壁镶有锡箔,外管外壁绕有铜线,当锡箔与铜线间接上高电压时,两管的管壁之间发生无声放电(没有火花的放电),O2就部分转变成了O3。
2.结构:O3中心O采取sp2不等性杂化:2个σ键,1个Π34,无单电子,反磁性。物理性质氧臭氧气体颜色液体颜色熔点/K沸点/K临界温度273K时水中的溶解度(ml/L)无色淡篮色54.69015449.1淡篮色暗篮色21.6160.6268494
3.性质:⑴.不稳定:常温下分解慢,437K以上快,MnO2、PbO2、Pt粉等作催化剂或紫外线辐射都会促使分O3解:2O3=3O2ΔrHθ=-284kJ·mol-1O3能量比O2高,不稳定,故有更强的氧化性:⑵.氧化性:PbS+4O3=PbSO4+4O2↑2NO2+O3=N2O5+O2↑臭氧从碘化钾溶液中析出碘:2KI+O3+H2SO4=I2+O2↑+K2SO4+H2O反应定量进行,可用来测定O3。(S2O32-测I2)
4.用途:饮水、空气消毒,染料脱色,微量有益,大量有害(>1ppm)。很微量的臭氧使人产生爽快和振奋的感觉,因微量的臭氧能消毒杀菌,能刺激中枢神经,加速血液循环。但空气中臭氧含量超过1ppm时,不仅对人体有害,而且对庄稼以及其它暴露在大气中的物质也有害,它的破坏性也是基于它的强氧化性。臭氧能氧化CN-而解毒,常被用来治理电镀工业中的含氰废水:O3十CN-=OCN-十O22OCN-十3O3=CO32-十CO2十N2十3O2
2—4过氧化氢一、制备和用途1.制备⑴.过氧化物的酸分解:在实验室中,可以将过氧化钠加到冷的稀硫酸或稀盐酸中来制备过氧化氢:Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2BaO2+CO2+H2O=BaCO3↓+H2O2BaO2+H2SO4=BaSO4↓+H2O2⑵.电解-水解法:(KHSO4或NH4HSO4)Pt电极2KHSO4K2S2O8(阳极)+H2↑(阴极)K2S2O8+2H2O=2KHSO4+H2O2过二硫酸钾溶解度较小,可沉淀出来,水解过二硫酸钾,并分馏可制得30~50%的H2O2溶液:
⑶.乙基蒽醌法以钯为催化剂在苯溶液中用H2还原乙基蒽醌变为蒽醇。当蒽醇被氧氧化时生成原来的蒽醌和过氧化氢。2-乙基蒽醌可以循环使用。当反应进行到苯溶液中的过氧化氢浓度为5.5g·L-1时,用水抽取之,便得到18%的过氧化氢水溶液。减压蒸馏可得高浓度溶液。2.用途:氧化剂、杀菌消毒、漂白织物、火箭燃料、废液消毒等。KCN+2H2O2=KOCN+H2OKOCN+2H2O=KHCO3+NH3↑
二、结构和性质1.结构有一个过氧链-O-O-,非直线性分子,3个σ。
2.性质淡蓝色粘稠液体,密度:293K1.4425g·cm-3。沸点:423K,熔点:272.7K。(1)稳定性较差(纯态较稳定),易催化分解。2H2O2=2H2O+O2ΔrHθ=-195.9kJ·mol-1加热、光照(320-380mm)、存在Fe2+、Mn2+、Cu2+、Cr3+、H+等离子,反应极易进行。在酸性溶液中电位在+0.695V到+1.776V之间的物质均可催化H2O2分解:2Fe2++H2O2=2Fe3++2H2O2Fe3++H2O2=2Fe2++O2总反应:2H2O2=2H2O+O2
(2)酸性:极弱酸。H2O2H++HO2-K2≈10-25在稀碱里,可以HO2-形式存在,但在浓碱中,则可生成过氧化物。如在40%氢氧化钠溶液:H2O2+2NaOH(40%)=Na2O2+2H2O加入乙醇的目的是为了减小产物Na2O2的溶解度。乙醇
(3)氧化还原性+0.401+1.23+0.87-0.08+1.77+0.68jByjAyHO2-OH-O2H2O2O2H2O22-OO2失2e-得2e-2-OO氧化剂:酸介质H2O2+2I-+H+=I2+2H2OPbS(黑)+4H2O2=PbSO4(白)+4H2O2Fe2++H2O2+2H+=2Fe3++2H2O碱介质2CrO2-+3H2O2+2OH-=2CrO42-+4H2O还原剂:遇到比自己更强的氧化剂时,呈还原性:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O在酸介质中,是一种强氧化剂,碱介质中是强还原剂,用它作氧化剂或还原剂,不会给体系带来杂质
问?:在酸性介质中,H2O2与Cl2相遇时,反应如何呢?ClO3-+1.471/2Cl2+1.358Cl-①.Cl2做氧化剂、H2O2做还原剂时:E1θ=1.36-0.68=0.68(V)②.Cl2做还原剂、H2O2做氧化剂时:E2θ=1.77-1.47=0.30(V)Eθ大的先反应,故:H2O2+Cl2=2HCl+O2↑H2O2同其它化合物反应转移过氧链,生成过氧化物或过氧酸。如:Cr(O2)2O4H2O2+Cr2O72-+2H+=2CrO5+5H2O2CrO5+7H2O2+6H+=2Cr3++7O2↑+10H2O检验:CrO5在乙醚中稳定,呈蓝色,故可用以检验CrO42-或Cr2O72-及H2O2的存在。
§15—3硫及其化合物3—1硫的同素异形体1.存在:硫在地壳中原子百分含量为0.03%。存在形式:单质硫和化合态硫ZnS、FeS2、Na2SO4·10H2O、BaSO4、CaSO4。2.硫的同素异性(形)体:原子间键合方式不同,晶体构型不同。多种,重要的两种:斜方硫和单斜硫。ΔrHθ=0.398kJ·mol-1
单斜硫单斜硫
斜方硫斜方硫
天然硫黄天然硫黄
弹性硫弹性硫
升华硫升华硫
S8环状结构3.硫分子结构——S8(皇冠构型)根据分子量测定单质S的分子相当于分子式S8,这个分子具有环状结构,每个S原子采取sp3杂化态,并形成两个共价单键。1273K左右蒸汽密度相当于S2分子(顺磁性)。S(环)S∞(线状)Sn、S8S6、S3、S2(蒸气)S倾入冷水中→弹性硫→静置→晶态硫433473523573T/K硫的相对粘度与温度的关系当温度升高时,S8环断裂形成链状分子,粘度增大,颜色变深。温度约473K时粘度最大,再升高,则长链断裂为小分子粘度变小,颜色变浅。
4.硫成键的两个显著特征⑴. 易形成多硫化合物-以多硫键为基础H2Sn、MSn、H2SnO6(n≥2)⑵. 金属元素的硫化物多以低价表现FeS、FeS2、OsS2(OsO4)5.制备:黄铁矿、单质硫矿3FeS2+12C+8O2=Fe3O4+12CO+6S6.性质:氧化还原性7.用途:硫酸、炸药、火柴
3—2硫化物和多硫化物一、硫化氢1.制备实验室通常采用金属硫化物与酸作用来制备:FeS(s)+H2SO4(aq)=H2S(g)+FeSO4(aq)Na2S(aq)+H2SO4(aq)=H2S(g)+Na2SO4(aq)硫化氢的水溶液还可以利用硫代乙酰胺的水解来制得:CH3CSNH2+2H2O=CH3COO-+NH4++H2S↑
2.性质(1)气味:刺激性臭鸡蛋味(2)溶解性:通常情况下1L的水溶解2.6L的硫化氢气体,浓度约为0.1mol/L。(3)酸性:弱酸,pK1=7.72,pK2=14.85。(4)还原性:强还原性。H2S+I2=2HI+S↓2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+8H2O+5S↓H2S+4Br2+4H2O=H2SO4+8HBr2H2S+O2=2H2O+2S↓(5)毒性:剧毒。
二、金属硫化物和多硫化物1.硫化物M2SMS及一些酸式盐名称化学式颜色在水中在稀酸中溶度积硫化钠硫化锌硫化锰硫化亚铁硫化铅硫化镉硫化锑硫化亚锡硫化汞硫化银硫化铜Na2SZnSMnSFeSPbSCdSSb2S3SnSHgSAg2SCuS白色白色肉红色黑色黑色黄色桔红色褐色黑色黑色黑色易溶不溶不溶不溶不溶不溶不溶不溶不溶不溶不溶易溶易溶易溶易溶不溶不溶不溶不溶不溶不溶不溶-1.2×10-231.4×10-183.7×10-193.4×10-283.6×10-292.9×10-591.2×10-254.0×10-531.6×10-498.9×10-45
部分硫化物颜色硫化锌硫化锰硫化镉硫化砷硫化锑硫化锡硫化铋
金属硫化物在酸中的溶解性金属硫化物与强酸作用产生H2S,根据其在酸中的溶解情况分成四类:Ⅰ.Ksp>10-24:能溶于稀盐酸,如:ZnS、MnS等ZnS+2HCl=ZnCl2+H2S↑Ⅱ.Ksp=10-25~10-30:能溶于浓盐酸如:CdS、PbS等Ⅲ.Ksp<10-30:不溶于浓盐酸而溶于硝酸如:CuS、Ag2S等3CuS+8HNO3=3Cu(NO3)2+3S↓+2NO↑+4H2OⅣ.Ksp更小:不溶于硝酸而溶于王水如:HgS等3HgS+12HCl+2HNO3=3H2HgCl4+3S+2NO↑+4H2O注:以上的Ksp以二价金属为标准。
Na2SO4+4C=Na2S+4CO水解性:Na2S+H2O=NaHS+NaOH2CaS+2H2O=Ca(OH)2+Ca(HS)2Cr2S3+6H2O=Cr(OH)3↓+H2S↑故Al2S3、Cr2S3不可能用湿法从溶液中制出。高温转炉1373K
2.多硫化物给碱金属或碱土金属硫化物的溶液中加入单质硫,单质硫可以溶解,原因时生成了多硫化物:Na2S+(x-1)S=Na2Sxx≥2(NH4)2S+(x-1)S=(NH4)2Sx多硫化物溶液一般显黄色,其颜色可随着溶解的硫的增多而加深,最深为红色。多硫离子具有链状结构,S原子通过共用电子对相连成硫链。
多硫化物在酸性溶液中很不稳定,容易生成硫化氢和硫。Sx2-+2H+=H2S↑+(x-1)S↓多硫化物具有氧化性并能发生歧化反应。由于在多硫化物中存在过硫链H—S—S—H,它与H2O2中的过氧链H—O—O—H类似:Na2S2+SnS(棕色)=SnS2(橙红色)+Na2SNa2S2=Na2S+S↓Na2S2在制革工业中用作原皮的脱毛剂,多硫化物是分析化学常用的试剂。多硫化钙CaS4在农业上用来杀灭害虫。多硫化物还可以发生歧化反应与S2-不同,Sx2-具有一定的氧化性,如
3—3硫的含氧化合物一.二氧化硫、亚硫酸及其盐S或H2S燃烧二氧化硫亚硫酸亚硫酸盐水吸收酸化碱吸收微酸化碱化酸化
SO2的结构类同O3:2个σ,1个Π34制备:S+O2=SO2Na2SO3+2H2SO4(浓)=2NaHSO4+SO2↑+H2O3FeS2+8O2=Fe3O4+6SO2↑
SO2是无色有刺激臭味有毒气体,可导致慢性中毒,丧失食欲,气管炎等。极性,易液化(常压263K)。液态SO2是良好溶剂。易溶于水,在常况下每l升水能溶解40升的SO2,相当于10%的溶液。SO2+xH2OSO2·xH2OH++HSO3-+(x-1)H2OK1=1.54×10-2HSO3-H++SO32-K2=1.02×10-7可形成酸式盐和正盐,加酸碱可使平衡移动。
酸性介质:θA:SO42-+0.17H2SO3+0.45S碱性介质:θB:SO42--0.93SO32--0.66SSO2、亚硫酸及其盐具有两性,但以还原性为主。还原性:2Na2SO3+O2(空气)=2Na2SO4(快)5SO32-+2MnO4-+6H+=2Mn2++5SO42-+3H2O氧化性:SO2+2H2S=3S+2H2O受热易分解:4Na2SO3=3Na2SO4+Na2S亚硫酸盐在酸性溶液中极不稳定:SO32-+2H+=SO2↑+H2O可用来制取气体和初步鉴别SO32-根。漂白织物时的去氯剂。
SO2的漂白性SO2的漂白性
二、三氧化硫硫酸硫酸盐SO2氧化三氧化硫SO3硫酸盐硫酸H2SO4催化氧化浓硫酸吸收与碱反应有关反应:V2O5723KSO2+O2======2SO3由于用水吸收会产生酸雾而得不到浓酸,因此实际是用浓硫酸吸收SO3得发烟硫酸,稀释得98%的浓硫酸。SO3+H2O===H2SO41.SO3生成
SO2结构与存在S:sp2杂化,3σ,1个Π46,具有双键性质。单个分子,平面三角形。固态有α、β、γ三种变体,γ变体为环状三聚体结构,β变体是链状结构,α为层状结构。稳定性:β>γ>α性质:强氧化剂:10SO3+P4=10SO2+P4O10SO3+2HBr=Br2+SO2↑+H2O
2.H2SO4SO3+H2O=H2SO4ΔrHθ=-79.4kJ·mol-1无色油状液体,凝固点283.4K,沸点611K(恒沸溶液98.3%硫酸),密度1.84g.cm-3,相当于18mol·L-1。浓硫酸溶于水产生大量热。
浓硫酸的特性a.吸水性和脱水性常用干燥氯气、氢气和二氧化碳等气体。能从有机化合物中夺取与水分子组成相当的氢和氧,使这些有机物碳化,表现出脱水性。C12H22O11(蔗糖)12C(黑)+11H2Ob.氧化性加热时氧化性更为显著(与铁、铝钝化,可做容器)S+2H2SO4=3SO2↑+2H2OC+2H2SO4=2SO2↑+CO2↑+2H2OCu+2H2SO4=CuSO4+SO2↑+2H2O
稀硫酸具有一般酸的特性,它是二元强酸。第一步完全电离,第二步点离不完全:K1=1×103K2=1.2×10-2硫酸根氧化能力极弱,它的氧化能力主要由电离出的H+所表现,只能与电位序在氢以前的活泼金属反应置换出氢气。如铁、铝、镁等,铅不与H2SO4反应,因为生成的PbSO4溶解度小,覆盖在金属的表面上,阻止反应的进一步进行。用途:硫酸是一种重要的基本化工原料,往往用硫酸的年产量来衡量一个国家的化工生产能力。肥料、石油、冶金、净水剂、造纸、充填剂、媒染剂、农药、炸药、重要化工原料等。
3.硫酸盐正盐酸式盐酸式盐:NaHSO4、KHSO4稳定。Na2SO4+H2SO4=2NaHSO4所有酸式盐和大部分的正盐是易溶于水难溶性硫酸盐是半径较大的碱土金属的硫酸盐,MgSO4>CaSO4>SrSO4>BaSO4易溶不溶最难溶常用来检验硫酸根或钡离子,它不溶于强酸溶液:Ba2++SO42-=BaSO4↓(白色)⑴.溶解性:
CuSO4CuO+SO3↑Ag2SO4Ag2O+SO3↑2Ag2O4Ag+O2↑⑵.热稳定性碱金属和碱土金属的硫酸盐热稳定性很强,18或9-17电子构型的金属离子硫酸盐稳定性较差:ΔΔΔ
⑶. 易形成复盐(矾)有两种形式的复盐:M2SO4·MSO4·6H2OM2SO4·M2(SO4)3·24H2O一价金属离子可以是:NH4+,K+,Rb+,Cs+二价金属离子可以是:Co2+,Ni2+,Zn2+,Cu2+,Mg2+三价金属离子可以是:Al3+,Fe3+,Cr3+,Ga3+,V3+,Co3+由两种简单盐组成的晶体称为复盐从溶液中结晶出来的硫酸盐,常常带有结晶水,这种带有结晶水的盐又常称为矾,如胆矾:CuSO4·5H2O,、绿矾:FeSO4·7H2O,明矾:K2SO4·Al2(SO4)3·24H2O、摩尔盐:(NH4)SO4·FeSO4·6H2O镁钾矾:K2SO4·MgSO4·6H2O等。⑷. 均为离子型化合物。离子无色,盐无色。
三.硫代硫酸及其盐1.硫代硫酸非常不稳定。若想直接制取它,需在195K、无水条件下硫化氢与三氧化硫或硫代硫酸钠与氯化氢作用可制得。H2S+SO3H2S2O3·nEt2ONa2S2O3+2HCl2NaCl+H2S2O3·nEt2O2.硫代硫酸盐:Na2S2O3·5H2O最重要:俗称海波或大苏打。⑴、硫代硫酸钠的制备煮沸①.Na2SO3+S = Na2S2O3②.2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2③.2H2S+2NaHSO3=3Na2S2O3+3H2O④.2Na2S+3SO2=2Na2S2O3+S↓
⑵、硫代硫酸根的结构⑶、硫代硫酸钠的性质在S2O32-的结构中,可以看作是硫酸根中的一个O原子被S原子取代,中心S原子是+6氧化数,另一个S原子是-2氧化数,平均氧化数是2,故具有还原性。①.硫代硫酸盐遇酸分解:S2O32-+2H+=SO2↑+H2O+S↓(刺激性气味,黄(乳白)色浑浊,可用于检验S2O32-)
②.中强还原剂2Na2S2O3+I2=Na2S4O6+2NaINa2S2O3+4Cl2+5H2O=2H2SO4+2NaCl+6HCl此反应能定量进行,可用于碘的滴定分析。此反应可用于作除氯剂,如做实验时,最后剩余的氯气可用Na2S2O3溶液或浸有Na2S2O3溶液的棉花来吸收。由上述反应可看出,硫代酸盐被氧化的产物是随氧化剂的强弱而不同的,与较强的氧化剂反应,产物为硫酸盐。
③. 作配位剂2S2O32-+Ag+=[Ag(S2O3]23-Hg2++2S2O32-=Hg(S2O32-)22-想一想:在溴化银沉淀中加入硫代硫酸钠,会有什么现象发生?AgBr+2S2O32-=[Ag(S2O3)2]3-+Br-故可用作照相底片或洗相片的定影液。即显影后,底片上多余的AgBr需要除去,而除去AgBr就是采用S2O32-去配合它的反应。
若是反过来,把硫代硫酸银溶液滴入硝酸银溶液,则开始银过量,生成白色的硫代硫酸银沉淀,它很不稳定,很快水解,发生白→黄→棕→黑 的颜色变化,最后水解主物是硫化银:Ag2S2O3+H2O=Ag2S+H2SO4此现象可用于硫代硫酸根的检验。滴入S2O32-AgNO3硝酸银滴入硫代硫酸钠溶液,则硫代硫酸钠过量,得到无色的硫代硫酸银配离子溶液。想一想:把硝酸银溶液滴入硫代硫酸钠溶液中和把硫代硫酸钠溶液滴入硝酸银溶液,得到的结果相同吗?
四.连二亚硫酸钠
Na2S2O4·2H2O,保险粉。1.结构:2.制备:无氧条件下,用锌粉还原NaHSO3:2NaHSO3+Zn=Na2S2O4+Zn(OH)23.性质:⑴.不稳定,易分解,易酸解:402K:2Na2S2O4=Na2S2O3+Na2SO3+SO2↑加酸:2Na2S2O4+4HCl=3SO2↑+S↓+4NaCl+2H2O⑵.还原剂:具有很强还原性,可作脱氧剂:2Na2S2O4+O2+2H2O=4NaHSO3Na2S2O4+O2+H2O=NaHSO3+NaHSO44.用途:还原剂、染料合成、漂白、造纸、医药等。
五.焦硫酸及其盐H2S2O7晶状固体,mp:308K1.焦硫酸的结构可看作是二分子硫酸脱一分子水而得到,冷却发烟硫酸可以析出无色的焦硫酸晶体,它溶于水成为硫酸。H2SO4+SO3=H2S2O7H2S2O7+H2O+2H2SO42.焦硫酸的性质焦硫酸具有比浓硫酸更强的氧化性、吸水性和腐蚀性。
2KHSO4K2S2O7+H2OK2S2O7K2SO4+SO3↑3.焦硫酸盐重要的焦硫酸盐是焦硫酸钾,它由硫酸氢钾加热至熔点以上而制得,继续加热则分解:K2S2O7与一些难溶的碱性金属氧化物共熔使其转化成可溶性硫酸盐:3K2S2O7+Fe2O3=Fe2(SO4)3+3K2SO43K2S2O7+Al2O3=Al2(SO4)3+3K2SO4
六、过硫酸及其盐1、过硫酸的结构过一硫酸过二硫酸过二硫酸可以看作是过氧化氢的氢原子被磺基-SO3H取代的产物,2、制备2KHSO4K2S2O8+H2↑
θ(S2O82-/SO42-)=2.05V加热2K2S2O8======2K2SO4+2SO3+O2加热Cu+K2S2O8======CuSO4+K2SO4Ag+2Mn2++5S2O82-+8H2O====2MnO4-+10SO42-+16H+过二硫酸盐不稳定,加热分解:3、过二硫酸钾的性质-强氧化性
七.连多硫酸通式:H2SxO6x=3~6,含-S-S-键。如:S2O32-+I2=S4O62-+2I-连四硫酸钠:从结构上看,S氧化数较低,有还原性,连二硫酸较稳定,连多硫酸还原性强,且热稳定性差。在浓溶液中易分解。H2S2O6=H2SO4+SO2↑H2S5O6=H2SO4+SO2↑+3S
3-4硫的其它化合物一.S2Cl2(二氯化二硫)将干燥氯气通入熔融硫可制得,为橙黄色有恶臭液体,易水解:2S+Cl2=S2Cl2硫的溶剂。2S2Cl2+2H2O=4HCl+SO2+3S二.SF6(六氟化硫)无色、无臭气体,不与水(动力学因素)、酸、碱反应,极稳定。
三.卤磺酸;含氧酸中的羟基被卤素取代后的衍生物叫做酰卤化物或卤化酰。卤化硫酰:SO2F2、SO2Cl2、SO2FCl。H2SO4中一个羟基被卤素取代即得到卤磺酸,如氟磺酸HSO3F、氯磺酸HSO3Cl等。SbF5与HSO3F反应得超强酸或超酸:SbF5+HSO3FH[SbF5(OSO2F)]H2SO3F++[SbF5(OSO2F)]-比100%H2SO4更强的酸称为超酸,HSO3F-SbF5,比100%H2SO4强1千亿倍!质子化作用试剂。HClO4比100%H2SO4强10倍,属超强酸。
§15—4硒和碲-自学硫的成键类型:1.除σ键外,有大π键;2.可形成d-pπ配键(反馈);3.长硫链,多硫化物,多硫酸
本章结束
苏教版六年级上册(语文综合性学习)读报和剪报
明代文人顾宪成的一副对联是这样的:风声雨声读书声,声声入耳;家事国事天下事,事事关心。
小组交流:平时你最喜欢读什么报纸?通常有几个版面?各版面是怎样分工的?你平常喜欢读哪几个栏目的文章?
黑板上将开辟“一句话新闻”专栏,专栏编辑将由大家轮流担任。轮到的同学要认真翻阅几种当天的报纸,从中筛选出最重要的国内、国际新闻,在仔细阅读的基础上,整理出几条“一句话新闻”,还可以把学校最近发生的大事写上去。究竟怎样编写呢,我们一起来实践一下。做一做要特别关注新闻中的几个要素,如时间、地点、人物、事件等,集体练习,将选出的新闻整理提炼成“一句话”。
考一考1、在报纸中常常会出现些新词儿,你知道它们的意思吗?炒股资讯打非曝光脱贫倒计时多媒体含金量地球村一头雾水白色污染豆腐渣工程
我能理解!炒股:买卖股票,也说炒股票。资讯:资料和讯息。打非:指依法打击制作、销售非法出版物和音像制品。曝光:(1)照相底片或感光纸感光并形成潜影的过程。(2)比喻把隐秘的事情(多为不体面的)披露出来,公之于众。
脱贫:摆脱贫困。倒计时:从将来的某一时刻起向现在由多到少计算时间,直到时间数为零时停止。多用来表示距某一时刻越来越近。多媒体:(1)多媒体技术的简称。它通过计算机在人机的交互控制下,对文字、图像、声音等多种视听信息进行综合采集、储存和处理。(2)运用多媒体技术的多种信息载体的统称。
含金量:(1)金锭或金制品中的纯含金量。(2)比喻事物的实际价值。地球村:对地球的一种比喻说法。现代科技的迅速发展,缩小了地球上的时空距离,国际交往日益频繁便利,因而整个地球就如同是茫茫宇宙中的一个小村落。一头雾水:比喻莫名其妙,摸不着头脑。白色污染:白色公害。豆腐渣工程:指施工中偷工减料,导致质量低劣的建筑工程。
学做剪报1、丢掉报纸或卖掉,许多有用的资料白白丢弃了,多可惜!如果将报上的有用资料分门别类剪贴成册,就能化废为宝,对报纸进行二次利用,该多有意义啊!2、剪报本——将写完的硬壳本,分类——将剪报本分为好几块,将你从报纸上剪下的内容分门别类地贴在相应位置装饰美化——有时间可用水彩为剪报加花边,配上插图。
时间:这项活动我们将持续2个月,一周检查一次,一月会进行一次成果展示会,看谁的剪贴本最吸引人。
成果展示1、召开班队会,评选观摩。请教师做评委,设奖项:“持之以恒奖”、“最佳创意奖”、“装帧精美奖”“内容丰富奖”
2、展示步骤:(1)实物展示与自我介绍相结合:上台向大家介绍自己剪贴本的优势,可从装帧、内容、特色等方面来说。(2)读者推荐:向大家推荐同学制作的优秀剪贴本,以读后感的角度来说。(3)评选优胜奖。这是多么有意义的活动啊,希望大家能坚持下去,珍惜和合理利用身边的资源。
人有了知识,就会具备各种分析能力,明辨是非的能力。所以我们要勤恳读书,广泛阅读,古人说“书中自有黄金屋。”通过阅读科技书籍,我们能丰富知识,培养逻辑思维能力;通过阅读文学作品,我们能提高文学鉴赏水平,培养文学情趣;通过阅读报刊,我们能增长见识,扩大自己的知识面。有许多书籍还能培养我们的道德情操,给我们巨大的精神力量,鼓舞我们前进。
'
您可能关注的文档
- 最新第13节心血管神经症-内科学第8版第二节(未完)课件PPT.ppt
- 最新第13课--五四运动习题课件PPT.ppt
- 最新第13课--交通和通讯的变化课件PPT.ppt
- 最新第13课-西欧经济和社会的发展(1)课件PPT.ppt
- 最新第14章-动载荷和交变应力总结课件PPT.ppt
- 最新第14章單因子變異數分析课件PPT.ppt
- 最新第14章-化学反应速率和化学平衡课件PPT.ppt
- 最新第14讲的设计建模课件PPT.ppt
- 最新第14篇-肺功能不全课件PPT.ppt
- 最新第15章--第1节--动物的运动方式课件PPT.ppt
- 最新第15讲-难溶电解质的溶解平衡课件PPT.ppt
- 最新第15讲-与营养有关疾病(1)课件PPT.ppt
- 最新第15讲--任意角、弧度制及任意角的三角函数课件PPT.ppt
- 最新第15章颅内压增高课件PPT.ppt
- 最新第15课-探寻新航路课件PPT课件.ppt
- 最新第16章 螺旋体课件PPT.ppt
- 最新第16章 螺旋体62440课件PPT.ppt
- 最新第17少年闰土657课件PPT.ppt