- 1.31 MB
- 2022-04-29 14:36:47 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'高三化学复习电解质溶液课件
【课前导引】
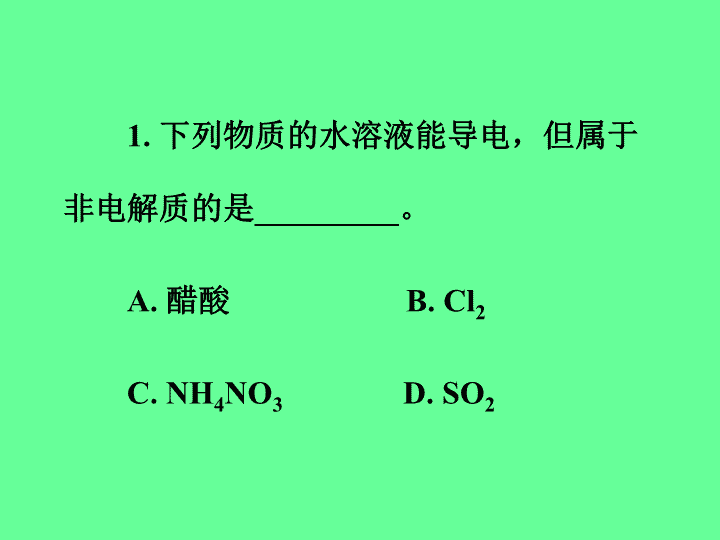
1.下列物质的水溶液能导电,但属于非电解质的是_________。A.醋酸B.Cl2C.NH4NO3D.SO2
【考点搜索】
1.了解强、弱电解质与结构的关系。2.理解弱电解质的电离平衡以及浓度等条件对电离平衡的影响。3.水的电离和水的离子积常数。4.溶液的PH值及有关PH值简单计算。5.理解盐类水解的实质,掌握水解的规律,学会盐类水解离子方程式的书写。6.了解盐类水解在生产、生活中的应用。7.使学生理解中和滴定的原理。8.使学生初步了解酸碱中和滴定的操作方法。9.使学生掌握有关酸碱中和滴定的简单计算。
【链接高考】
例1(05江苏8题)在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液体积等于Ba(OH)2溶液与NaHSO4溶液体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是:A.1:9B.1:1C.1:2D.1:4
解析:本题属于PH计算的考查范畴。本题中可假设Ba(OH)2溶液的体积为1L,因为n(Ba2+)=0.005mol,n(OH-)=0.01mol,剩余的n(OH-)=0.005mol。而此时OH-的浓度为0.001mol/L,总体积应为5L,故加入的NaHSO4溶液的体积为4L,答案应该是D。解决此类问题的关键是进行合理的假设。
例2(05江苏12题)常温下将稀NaOH溶液与稀CH3COOH混合,不可能出现的结果是:A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)B.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)C.pH<7,且c(CH3COO-)>c(Na+)>c(H+)>c(OH-)D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
解析:本题属于基本概念与理论的考查。落点在离子浓度的大小比较,即水解和电离的平衡。此题比较常规,只要对四个选项分别进行研究即可解决。A中PH>7时,即为碱性条件,稀NaOH溶液与稀CH3COOH溶液混合后,只有可能是CH3COONa溶液或者是NaOH溶液过量又或者是CH3COONa和极少量CH3COOH剩余的情况。
因此不可能是c(OH-)>c(Na+),更不可能是c(H+)>c(CH3COO-);B选项不管在溶液显示为何种性质的条件下,均应该满足电荷守恒;C选项完全是可能的,即当CH3COOH剩余,溶液中是CH3COOH和CH3COONa的混合溶液,且CH3COOH剩余较多;D中PH=7时,根据电荷守恒,c(CH3COO-)=c(Na+)。因此本题答案为A、D。
解决这类试题关键是掌握三种守恒关系的书写与理解。此类题的考查趋势是:单一的电解质溶液、酸碱反应后溶液、酸式盐溶液、多种盐混合溶液中离子浓度的大小比较。
【在线研究】
1.将0.lmol.L-1醋酸溶液加水稀释,下列说法正确的是:A.溶液中c(H+)和c(OH-)都减小B.溶液中c(H+)增大C.醋酸电离平衡向左移动D.溶液的pH增大
命题意图:本题以弱电解质电离平衡为依托,考查弱电解质在加水稀释条件下的电离平衡走向,以及溶液中各种离子浓度大小的变化,以此考查考生思维的灵活度和深广度。
解题思路:在醋酸溶液中存在如下电离平衡:CH3COOH+H2OCH3COO-+H3O+加水稀释虽可使醋酸的电离平衡向电离的方向移动,H3O+数目增加,但由于加水稀释时溶液的体积变化占了主导地位,所以c(H3O+)减小,PH增大。答案为D。
2.已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是:A.在Na2A、NaHA两溶液中,离子种类不相同B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
命题意图:本题主要考查电离平衡、盐类水解等理论知识。弱电解质的电离平衡、盐类的水解平衡都会反映到溶液中各种离子浓度的关系之中,从分析离子关系角度考查电离平衡和盐类水解平衡理论知识,可以较好地区分学生对相关理论内容的理解水平。
解题思路:根据题给条件可判断,H2A的第一级电离就较弱,属于弱酸。所以在Na2A、NaHA溶液中由于水解和电离,两溶液中所含离子种类数肯定相同。在Na2A溶液中,由于A2-水解,阴离子总数增加,所以两溶液中阴离子总数前者多。任何溶液中,阳离子所带正电荷总数跟阴离子所带负电荷总数必定相等。所以,在Na2A溶液中H+浓度小于OH-离子浓度。本题答案选C。
【方法论坛】
1.强、弱电解质及其与结构的关系强电解质弱电解质电离程度几乎完全电离部分电离结构特征离子键,强极性共价键电离平衡不可逆,无电离平衡弱极性共价键可逆,存在电离平衡
强电解质弱电解质电解质粒子无电解质分子,只存在电离出来的离子同时存在电解质的分子和离子电离方程式NaOH=Na++OH-H2SO4=2H++SO42-CH3COOHH++CH3COO-NH3·H2ONH4++OH-实例盐:NaCl、BaSO4、NaHCO3强酸:H2SO4、HNO3、HI强碱:NaOH、Ba(OH)2弱酸:HF、CH3COOH、H3PO4弱碱:NH3·H2O、Fe(OH)3水:H2O
2.电离方程式:强电解质在溶液中全部电离,在电离方程式中以“=”表示之;弱电解质不能全部电离,在电离方程式中以“”表示之;多元弱酸分步电离,在书写电离方程式时要分步书写,如H2CO3电离时常以下式表示:H2CO3H++HCO3-、HCO3-H++CO32-;多元弱碱分步电离,但常常一步写到底,如Cu(OH)2Cu2++2OH-。
3.影响水的电离的因素:①升高温度可以促进水的电离,所以,升温时Kw增大;例如,100℃时,Kw=110-12;②在25℃时,把酸、碱溶入水中,水的电离受到抑制,由水电离出的H+、OH-都减小,但水溶液中所有H+、OH-的浓度的乘积不变,仍为110-14;
③保持25℃不变,把NH4Cl这样易水解的盐溶入水中,水电离受到促进,由水电离出的H+、OH-都增多,但OH-有一部分会与NH4+结合成NH3·H2O,所以,溶液中H+、OH-浓度的乘积仍为1×10-14;④水的离子积是只与温度有关的常数,在25℃时,纯净水或酸溶液、或碱溶液、或盐溶液中,H+、OH-浓度的乘积保持不变:Kw=110-14;
4.盐类水解的一般规律有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,都强显中性。例:物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是:______________
因为NaZ溶液的碱性最强,则Z-离子水解程度最大。HZ的酸性最弱。因此HX、HY、HZ的酸性由强到弱的顺序是HX>HY>HZ.
5.运用三种守恒关系判断溶液中粒子浓度大小。电解质溶液中的离子之间存在着三种定量关系:①物料守恒:例如在Na2CO3溶液中:1/2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);又如在NaH2PO4溶液中:c(Na+)=c(H3PO4)+c(H2PO4-)
+c(HPO42-)+c(PO43-);
②电荷守恒:例如在NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-);又如在Na2HPO4溶液中:c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-);
③质子守恒:如Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+);又如Na3PO4溶液中:c(OH-)=c(HPO42-)+2c(H2PO4-)+3c(H3PO4)+c(H+);
6.中和滴定的原理(1)定量分析:化学上把测定物质各组成成分的含量过程,称为定量分析过程。中和滴定是定量分析的一种方法。(2)中和滴定:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法就叫酸碱中和滴定。实质:H++OH—=H2O即酸中的H+和碱中的OH-物质的量相等。
(3)计算原理:mHnR+nM(OH)m=MnRm+mnH2OmnC1·V1C2·V2则有:n·C1·V1=m·C2·V2其中C1、C2分别表示酸和碱的浓度,V1、V2分别表示酸和碱的体积。
(4)中和滴定的关键:①准确测定溶液的体积②准确显示反应的终点
7.中和滴定的仪器的使用,操作方法及步骤(1)仪器:酸式、碱式滴定管,滴定管夹,锥形瓶。酸式滴定管:玻璃活塞;碱式滴定管:不能用玻璃活塞(为什么?)注意:①零刻度在上方②滴定管可以读到小数点后两位
(2)药品:标准液;待测液;指示剂。(3)准备过程:洗涤:用洗液洗→检漏:滴定管是否漏水→用水洗→用标准液洗(或待测液洗)注意:为什么用水洗后,还要用标准液洗?但锥形瓶不能用待测液洗?→装溶液→排气泡→调液面→记数据V(始)洗涤后滴定管中装标准溶液,并读下读数,锥形瓶中装一定体积的待测液,并放几滴指示剂于锥形瓶中
(4)滴定:左手控制滴定管旋塞,右手拿住锥形瓶颈,边滴入标准液边不断摇动;眼睛要始终注视锥形瓶中溶液的颜色变化。当看到加一滴标准液时,锥形瓶中溶液颜色突变时,停止滴定。待30s不变色,准确记下标准液读数,并准确求得滴定用去的标准液体积。滴定操作重复2~3次。将几次滴定用去盐酸体积的平均值代入关系式计算。
【实弹演练】
[课堂反馈]1.下列叙述正确的是:A.强电解质都是离子化合物,因此NaCl是离子化合物B.醋酸溶液的导电能力可能比稀硫酸强C.SO3溶于水,其水溶液能导电,SO3是电解质D.硫磺是单质,不导电,因此硫磺是非电解质
[课堂反馈]1.下列叙述正确的是:A.强电解质都是离子化合物,因此NaCl是离子化合物B.醋酸溶液的导电能力可能比稀硫酸强C.SO3溶于水,其水溶液能导电,SO3是电解质D.硫磺是单质,不导电,因此硫磺是非电解质B
2.pH相同的氨水和氢氧化钠两种溶液中它们的:A.H+的物质的量相同B.物质的量浓度相同C.OH-的物质的量浓度相同D.OH-的物质的量浓度不同
2.pH相同的氨水和氢氧化钠两种溶液中它们的:A.H+的物质的量相同B.物质的量浓度相同C.OH-的物质的量浓度相同D.OH-的物质的量浓度不同C
3.常温时,以下4种溶液pH最小的是:A.0.01mol·L-1醋酸溶液
B.0.02mol·L-1醋酸与0.02mol·L-1NaOH溶液等体积混合液
C.0.03mol·L-1醋酸与0.01mol·L-1NaOH溶液等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液
3.常温时,以下4种溶液pH最小的是:A.0.01mol·L-1醋酸溶液
B.0.02mol·L-1醋酸与0.02mol·L-1NaOH溶液等体积混合液
C.0.03mol·L-1醋酸与0.01mol·L-1NaOH溶液等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液A
4.室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离的c(OH-)的数据分别为:甲:1.0×10-7mol·L-1;乙:1.0×10-6mol·L-1;丙:1.0×10-2mol·L-1;丁:1.0×10-12mol·L-1。其中你认为正确的数据是:A.甲、乙B.乙、丙C.丙、丁D.乙、丁
4.室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离的c(OH-)的数据分别为:甲:1.0×10-7mol·L-1;乙:1.0×10-6mol·L-1;丙:1.0×10-2mol·L-1;丁:1.0×10-12mol·L-1。其中你认为正确的数据是:A.甲、乙B.乙、丙C.丙、丁D.乙、丁C
5.下列说法正确的是:A.0.020mol/L的HCN(aq)与0.020mol/LNaCN(aq)等体积混合得到碱性混合溶液中:c(Na+)>c(CN-)B.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(A2-)=c(OH-)+c(H2A)C.在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol/LD.c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:c[(NH4)2SO4]>c(NH4HCO3)>c(NH4Cl)
5.下列说法正确的是:A.0.020mol/L的HCN(aq)与0.020mol/LNaCN(aq)等体积混合得到碱性混合溶液中:c(Na+)>c(CN-)B.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(A2-)=c(OH-)+c(H2A)C.在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol/LD.c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:c[(NH4)2SO4]>c(NH4HCO3)>c(NH4Cl)A
6.某学生用0.10mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm(B)用标准溶液润洗滴定管2-3次(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液(D)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(E)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度:(F)调节液面至0或0刻度以下,记下读数:完成以下填空:(1)正确操作的顺序是(用序号字母填写):_______________________
(E)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度:(F)调节液面至0或0刻度以下,记下读数:完成以下填空:(1)正确操作的顺序是(用序号字母填写):_______________________BACFDE
(2)上述(B)操作的目的是:_________________________________(3)上述(D)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同):___________________________
(2)上述(B)操作的目的是:_________________________________(3)上述(D)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同):___________________________防止将标准液稀释
(2)上述(B)操作的目的是:_________________________________(3)上述(D)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同):___________________________防止将标准液稀释偏大
(4)实验中用左手控制_______________(填仪器及部位),眼睛注视__________________________________,直至滴定终点。判断到达终点的现象是:
(4)实验中用左手控制_______________(填仪器及部位),眼睛注视__________________________________,直至滴定终点。判断到达终点的现象是:滴定管玻璃球
(4)实验中用左手控制_______________(填仪器及部位),眼睛注视__________________________________,直至滴定终点。判断到达终点的现象是:滴定管玻璃球锥形瓶中
(4)实验中用左手控制_______________(填仪器及部位),眼睛注视__________________________________,直至滴定终点。判断到达终点的现象是:滴定管玻璃球锥形瓶中溶液的颜色变化
(4)实验中用左手控制_______________(填仪器及部位),眼睛注视__________________________________,直至滴定终点。判断到达终点的现象是:滴定管玻璃球锥形瓶中溶液的颜色变化锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是_______。(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是_______。(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是________。偏小
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是_______。(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是________。偏小偏小
[课后巩固A]1.离子方程式NH4++2H2OH3O++NH3·H2O所代表的是:A.氨水与盐酸反应的逆反应B.醋酸铵晶体溶于水C.碳酸铵晶体溶于水D.氯化铵溶液与过量NaOH溶液反应
[课后巩固A]1.离子方程式NH4++2H2OH3O++NH3·H2O所代表的是:A.氨水与盐酸反应的逆反应B.醋酸铵晶体溶于水C.碳酸铵晶体溶于水D.氯化铵溶液与过量NaOH溶液反应A
2.(长郡原创)下列公式中哪一个能用来精确地计算任意浓度盐酸中氢离子的物质的量浓度c(H+)(Kw为水的离子积常数):A.c(H+)=c(HCl)B.c(H+)=c(HCl)+Kw/c(H+)C.c(H+)=c(HCl)+KwD.c(H+)=c(HCl)-Kw/c(H+)
2.下列公式中哪一个能用来精确地计算任意浓度盐酸中氢离子的物质的量浓度c(H+)(Kw为水的离子积常数):A.c(H+)=c(HCl)B.c(H+)=c(HCl)+Kw/c(H+)C.c(H+)=c(HCl)+KwD.c(H+)=c(HCl)-Kw/c(H+)B
3.在水中溶入下列物质,可使水的电离平衡向右移动的是:①H2SO4②NH4Cl③Cl2④NaOH⑤NaA.①②④B.②③⑤C.②③④D.①④⑤
3.在水中溶入下列物质,可使水的电离平衡向右移动的是:①H2SO4②NH4Cl③Cl2④NaOH⑤NaA.①②④B.②③⑤C.②③④D.①④⑤B
4.NaHS溶液中滴入酚酞试液显红色。在0.1mol·L-1NaHS溶液中,下列关系正确的是:A.c(Na+)==c(H2S)+c(HS-)+c(S2-)B.c(HS-)+c(S2-)==0.1mol·L-lC.c(S2-)>c(HS-)>c(H+)>c(OH-)D.c(Na+)+c(H+)==c(HS-)+c(OH-)+c(S2-)
4.NaHS溶液中滴入酚酞试液显红色。在0.1mol·L-1NaHS溶液中,下列关系正确的是:A.c(Na+)==c(H2S)+c(HS-)+c(S2-)B.c(HS-)+c(S2-)==0.1mol·L-lC.c(S2-)>c(HS-)>c(H+)>c(OH-)D.c(Na+)+c(H+)==c(HS-)+c(OH-)+c(S2-)A
5.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系正确的是:A.c(OH-)c(X-),则下列关系正确的是:A.c(OH-)
(1)在两个方案的第①步中,都要用到的定量仪器是______________________(2)甲方案中,说明HA是弱电解质的理由是测得溶液的PH_____1(选填>、<、=);乙方案中,说明HA是弱电解质的现象是______(多选扣分)(a)装HCl的试管中放出H2的速率快(b)装HA溶液的试管的中放出H2的速率快(c)两个试管中产生气体速率一样快100mL溶量瓶>b
(3)请你评价:乙方案中难以实现之处和不妥之处:(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
(3)请你评价:乙方案中难以实现之处和不妥之处:(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒表面积难以做到相同。
(3)请你评价:乙方案中难以实现之处和不妥之处:(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒表面积难以做到相同。配制NaA溶液,测其pH值>7即证明HA是弱电解质。
7.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
请回答下列问题:(1)第二次实验中产生沉淀的质量是______g(2)求混合物中K2CO3和NaHCO3的物质的量之比;(要求写出计算过程)。
请回答下列问题:(1)第二次实验中产生沉淀的质量是______g(2)求混合物中K2CO3和NaHCO3的物质的量之比;(要求写出计算过程)。2.758
请回答下列问题:(1)第二次实验中产生沉淀的质量是______g(2)求混合物中K2CO3和NaHCO3的物质的量之比;(要求写出计算过程)。2.758以第一组数据计算,设样品混合物中NaHCO3和K2CO3的物质的量分别为xmol和ymol。
(3)在25℃时,取下第3组实验所得溶液体积的1/10,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。设第4次实验中CO32—、HCO3—恰好生成沉淀,且沉淀质量为x′g,则有:BaCO3~CO32—1971molx′(0.002+0.005)×4x′=5.516g
或:由于第一次与第四次样品的质量比为:3.432:0.858=4:1而第一次与第四次沉淀的质量比为5.516:1.379=4:1故第4次实验恰好沉淀,则原0.5LBa(OH)2溶液中:2OH—~Ba(OH)2~BaCO32mol197gc(OH)-5.516g
设第三次实验消耗OH—的物质的量为ZNaHCO3~OH—1mol1mol0.002×3molZ
九上古诗文理解性默写
出师表11文中与“先帝不以臣卑鄙”中的“卑鄙”一词相呼应的句子是,,,。2“先帝知臣谨慎,故临崩寄臣以大事也”中的“大事”具体指(用文中一个四字词语作答)。3作者认为可以出师北伐的条件是,。4文中表现诸葛亮对后主殷切希望的语句是,,,。5、“三顾频频天下计,两朝开济老臣心。”文中最能体现“老臣心”的一句话是:。
出师表26、“先帝在时,每与臣论此事,未尝不叹息痛恨于桓、灵也”中的“此”指代的是:,,。7、表明自己无意于功名的句子是:,。8、诸葛亮在出师前,对蜀汉面临的形势进行了一分为二的分析,其中指出的不利因素是:,,。有利因素是:,。9、文中揭示先汉兴隆原因的句子,,。10、诸葛亮鞠躬尽瘁地辅佐刘备父子,得到了人们极高的赞誉。这可借用辛弃疾《破阵子为陈同甫赋壮词以寄之》的词句来概括,。11、文中,诸葛亮提出“赏罚分明”建议的依据是,。
《渔家傲·秋思》1词中最能体现将士们思乡报国的句子:,。2与王之涣《凉州词》中“一片孤城万仞山”诗句意境相似的句子,。3王维《使至塞上》中的名句“大漠孤烟直,长河落日圆”,可以使人联想到范仲淹《渔家傲秋思》中的词句,。
《江城子·密州出猎》1表达词人虽然年纪不轻但不以为意仍然意气风发、渴望建功立业的豪情的词句:,。2词中运用典故以魏尚自喻希望朝廷有朝一日能启用自己:,。3表达词人效命疆场杀敌报国的豪情壮志,而且写出了词人对自己充满信心的句子:,,。
《武陵春》1词中最能表达作者晚年生活的磨难和内心的悲观的句子是,2苏轼《虞美人》中有“只载一船离恨向西州”的句子,此词中与之异曲同工之妙的句子是,。
《破阵子》1表现醉态和梦境情景的句子是哪句,。2写官兵同甘共苦,战歌雄壮,再现军中壮观、热烈场面的句子是哪句,。3刻画冲锋陷阵杀敌报国的英雄形象,反映作者杀敌立功愿望的句子是,。4尽吐壮志难酬的无限感慨,揭示理想与现实的尖锐对立的句子是。
综合1诗有形,那是“锦帽貂裘,”的狩猎场景;诗有声,那是“马作的卢飞快,”的塞外强音;诗有味,那是“零落成泥碾作尘,”的暗香浮动;诗有,那是。2,斜晖脉脉水悠悠。(温庭筠《望江南》)3受任于败军之际,。
参考答案《出师表》1臣本布衣,躬耕于南阳,苟全性命于乱世,不求闻达于诸侯。2兴复汉室。3南方已定,兵甲已足。4陛下亦宜自谋,以咨诹善道,察纳雅言,深追先帝遗诏5此臣所以报先帝而忠陛下之职分也。6亲小人,远贤臣,此后汉所以倾颓也。
参考答案7苟全性命于乱世,不求8不利因素:先帝创业未半而中道崩殂,今天下三分,益州疲弊有利因素:侍卫之臣不懈于内,忠志之士忘身于外。9亲贤臣,远小人,此先汉所以兴隆也。10了却君王天下事,赢得生前身后名11宫中府中,俱为一体
参考答案《渔家傲·秋思》1浊酒一杯家万里,燕然未勒归无计。2千嶂里,长烟落日孤城闭。3千嶂里,长烟落日孤城闭。《江城子·密州出猎》1鬓微霜,又何妨!2持节云中,何日遣冯唐?3会挽雕弓如满月,西北望,射天狼。
参考答案《武陵春》物是人非事事休,欲语泪先流。只恐双溪舴艋舟,载不动许多愁。《破阵子》醉里挑灯看剑,梦回吹角连营。八百里分麾下炙,五十弦翻塞外声。了却君王天下事,赢得生前身后名。可怜白发生。
参考答案综合1千骑卷平岗弓如霹雳弦惊只有香如故色“接天莲叶无穷碧,映日荷花别样红”的绚丽夺目2过尽千帆皆不是3奉命于危难之间'
您可能关注的文档
- 最新高一化学必修一-第三章第二节-几种重要的金属化合物-课件PPT【精品】[1]课件ppt.ppt
- 最新高一地理:8.1《环境问题的表现与分布》课件旧人教版课件PPT.ppt
- 最新高一家长会课件PPT.ppt
- 最新高一地理水循环和洋流概要课件PPT.ppt
- 最新高一地壳的物质组成和物质循环课件PPT课件.ppt
- 最新高一数学任意角的三角函数及三角函数线课件PPT课件.ppt
- 最新高一氨气及铵盐课件PPT.ppt
- 最新高三一轮复习Boo4U5课件PPT.ppt
- 最新高三化学高考复习-离子共存专题-课件(24张)-(共24张PPT)课件PPT.ppt
- 最新高三化学电解质离子反应复习课件课件PPT.ppt
- 最新高三化学二轮复习:专题六《原电池、电解原理及其应用》课件PPT课件.ppt
- 最新高三地理第二轮复习专题一---等值线的判读资料课件PPT.ppt
- 最新高三总复习语法课件PPT.ppt
- 最新高三政治《系统集成_必修3文化生活第二轮复习_核心考点》(课件)课件PPT.ppt
- 最新高三数学一轮复习-第十一章-统计、统计案例第二节-用样本估计总体课件课件PPT.ppt
- 最新高三物理热学、光学和原子物理(2)课件PPT.ppt
- 最新高三物理二轮专题复习课件:万有引力定律及其应用模板课件PPT.ppt
- 最新高三文科一轮复习策略与技巧课件PPT.ppt