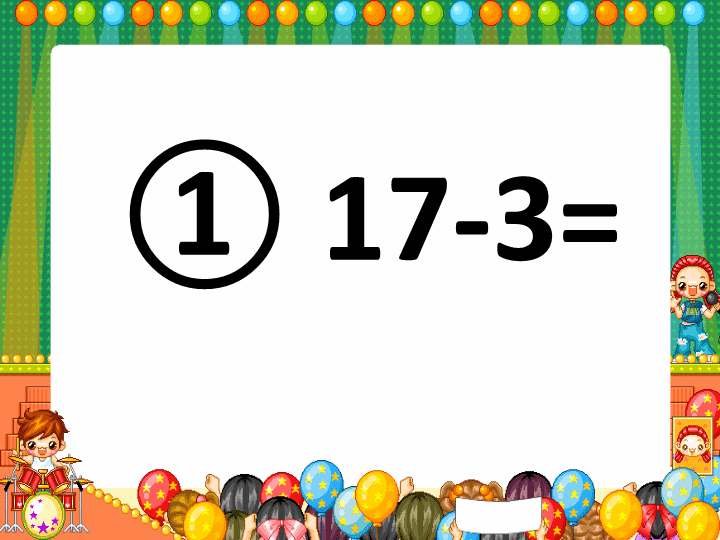- 555.50 KB
- 2022-04-29 14:48:06 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'两位数减一位数退位减法练习课
谁是神速王?
①17-3=
⑤28-9=
⑥60-5=
⑦72-30=
⑧59-8=
⑨70-6=
⑩58-7=
谁是神眼王?
46-8=28×
70-8=68×
34-20=32×
52-6=56×
做口算一定要仔细哦!
小红参加数学比赛,和参加比赛的每个人握一次手。小红一共握了39次手。参加数学比赛的一共有多少人??
(一)质量管理2010版GMP中本章节共有条款34条,现场检查发现缺陷项目所涉及的条款有6条,其中出现频次较高的缺陷项目内容涉及条款为第13条,主要缺陷项目为第12、13条。主要存在问题为:1.质量风险管理不到位。主要表现在未在实际生产过程中运用质量风险方法进行评估或评估依据不足;未对研发、临床使用的风险进行识别,未记录风险沟通、审核的过程,未使用风险分析方法对整个产品生命周期进行科学评估。2.从事质量检验的人员缺乏基本理论知识及实际操作技能。20
(一)质量管理举例:偏差和变更控制案例中缺少风险评估的程序及数据。(第14条)分析:企业应将质量风险管理理念贯穿于质量和生产的各个方面,如对变更的风险分析可以前瞻性地预测变更带来的影响,更好地改进变更方案。对偏差进行调查处理的过程中,寻找、确定潜在的根源时可以运用风险管理的理念和方法。21
(二)机构与人员本章节共有条款16条,现场检查发现缺陷项目所涉及的条款有109条,其中出现频次较高的缺陷项目内容涉及条款为第27条;严重缺陷项目为第27条;主要缺陷项目涉及的条款分别为第18、25、27条。主要存在问题有:1.培训不到位。主要表现在未结合岗位要求进行培训;培训记录不全;未对培训效果进行评估或评估内容不全。2.企业配备人员不足。部分岗位工作由其他岗位人员兼职完成,造成个别人员承担职责过多,不能完全履行职责。22
(二)机构与人员举例l:未设置企业质量管理负责人,现有的质量管理部门经理不具备企业质量管理负责人的相应职责。(第23条)(主要缺陷)举例2:多个岗位人员培训不到位,如(1)仓库人员没有按规定进行通风,物料标识品名填写不规范;(2)温湿度记录没有按照SOP执行;(3)记录表中有修改没有签字;(4)QC微生物检验人员佩戴项链、戒指进入微生物实验室(C级),从微生物限度检测室出来未关紧门接着进入无菌检查室。(第27条)(主要缺陷)23
(二)机构与人员举例3:企业配备人员不足。部分岗位工资由其他岗位人员兼职完成,造成个别人员承担职责过多,不能完全履行职责。(第18条)分析:因该企业同时存在QA与QC人员数量不足,实际操作能力欠佳,不能保证产品的质量等问题,因此,缺陷合并,上升为严重缺陷。无菌药品认证举例:无菌制剂车间改造后,灌封洁净级别发生变更,未及时对操作人员进行无菌操作区域人员行为规范方面的培训,如行走速度、动作幅度、交谈等方面的规定。(第28条)24
(三)厂房与设施本章节共有条款28条,现场检查发现缺陷项目所涉及的条款有73条,其中出现频次较高的缺陷项目内容涉及条款为第65条、第58条、第43条、第42条,主要缺陷项目4条,分别为第40、61、第46条、第42条。主要存在问题有:1.防止粉尘扩散、排热排湿、避免交叉污染措施不到位。主要表现在称量间、粉碎间、分装间、干燥间、清洗间、配滤间等房间无捕尘、排风设施或效果不佳。25
(三)厂房与设施2.仓库取样车不能有效防止污染或交叉污染。3.精密仪器室避免受静电、震动、潮湿等其他因素干扰的措施不足。4.生产区、仓储区防止昆虫或动物进入设施不到位。26
(三)厂房与设施无菌药品认证举例1:某c级生产车间的称量间内分设有并排的3个称量柜,活性炭称量柜(含润炭)、散装原辅料称量柜和整包原辅料称量柜,称量间各称量柜的结构、送风口、直排风口布局不合理,且该称量间与浓配间有一个直通传递原料窗口,存在污染和交叉污染风险。(第53条)分析:产尘操作间应采取专门的措施防止粉尘扩散,避免交叉污染并便于清洁。27
(三)厂房与设施无菌药品认证举例2:小容量注射剂灌封A/B级区尘埃粒子每批监测一次,监测点为出瓶口和灌装点;浮游菌每批监测一次,监测点为灌装点。对于无菌工艺灌装的产品,无菌灌装时尘埃粒子和微生物监控不够充分。(无菌附录10、11)28
(四)设备新版GMP中本章节共有条款31条,现场检查发现缺陷项目所涉及的条款有266条,其中出现频次较高的缺陷项目内容涉及的条款为第80条、第87条、第86条;主要缺陷项目涉及的条款为第83条。主要存在问题:1.没有制定设备的预防性维护计划。2.用于生产或检验的设备和仪器使用日志不规范。主要表现在缺少使用记录、维护记录、记录不全或未按日志管理。3.设备操作规程的可操作性不强,如操作规程的操作内容不全或内容制定不合理。29
(四)设备4.部分用于生产或检验的仪器、量具未经校准。5.未对水系统进行定期监测。主要表现在水系统清洗、消毒、运行记录不全;制药用水检测记录不全。6.称量用电子秤、分析天平使用不规范。如无设备编号,量程与所称量物料不相符,使用前未进行校准检查。7.共用设备未对清洁残留物进行评估。30
(四)设备无菌药品认证举例1:水浴灭菌柜内除置于产品内的穿刺探头外,均未设置移动温度探头,不利于监测灭菌柜几何中心位置温度;企业自备验证仪,配备了12个无线温度探头,对于软袋线灭菌柜,温度探头相对较少,不利于正确判断设备冷点;灭菌柜没有配置喷淋水流速和压力监测仪器或仪表。(第71条)分析:灭菌柜设备选型上存在缺陷。31
(四)设备无菌药品认证举例2:未制定设备的预防性维护计划和规程,使用临时性的方法进行设备维护。(第80条)分析:设备预防性维护目的是确保设备处于持续的验证状态,关键设备的预防性维护应受质量管理体系的监督。32
(四)设备举例3:部分批次产品投料量小于企业混合设备经确认的最小混合量。(第83条)分析:市场抽验发现某企业生产的复方制剂某些批次含量不合格,经现场检查发现企业投料量小于设备的最小混合量,从而造成物料混合不均匀。33
(五)物料和产品本章节共有条款36条,现场检查发现缺陷项目所涉及的条款有37条,其中出现频次较高的缺陷项目内容涉及条款为第106条、第112条、第103条、第119条;主要缺陷项目涉及的条款分别为第115条。主要存在问题:1.物料标签管理不规范:如缺少物料标识、物料标签内容不全或不规范;中间产品标签名称填写不正确、未标明贮存条件及效期。34
(五)物料和产品2.物料存放不规范,主要表现在未按品种;批号分开贮存和周转;标签、说明书未按要求存放。3.物料传递不规范,主要表现在无自净/消毒时间规定或记录。4.尾料回收管理未经质量评估,未确定回收内控标准、存放条件、效期等。35
(五)物料和产品无菌药品认证举例小容量注射剂灯检不合格品经清洗、破瓶、监测PH值和色度后按照总批量10%以下的限量,加入下批配制液中回收。(第133条)36
(六)确认与验证本章节共有条款12条,现场检查发现缺陷项目所涉及的条款有29条,其中出现频次较高的缺陷项目内容涉及条款为148条、第140条;主要缺陷项目内容涉及条款为第143条主要存在问题:如:(1)缺少验证条件确认内容(2)缺少分析评价内容(3)未对取样方法、检测方法进行方法学验证。(4)针对工艺变化、物料供应商变化等未进行风险评估及确认;(5)工艺规程规定的批量及最小批量未经验证;(6)缺少消毒效期的验证,缺少对消毒剂残留检测的内容;(7)缺少对有机溶剂残留、共线设备的化学残留的检测,或对检测方法进行验证。37
(六)确认与验证主要存在问题:2.未根据验证结果确认工艺参数。3.验证记录不全。如缺少高效检漏记录、清洗验证的相关记录;缺少检验色谱图、检验原始记录等。4.企业未做清洁剂、消毒剂(1%NaOH,0.2%新洁尔灭,甲醛)的残留限度检测验证方法不够合理。一是未做甲醛、新洁尔灭的残留限度检测,二是取样方法缺少代表性,三是未做取样回收率检测(第143条)。38
(六)确认与验证无菌药品认证举例2:企业新变更使用的洗烘灌联动线设备确认与验证工作不完善,灌装前的安瓿在转运过程中靠近灌装处破损率比较高,导致产品收率低。(第140条、第142条)(主要缺陷)39
(六)确认与验证无菌药品认证举例3:注射用水系统验证报告不完整,未按2010版药典微生物限度检测法要求逐日观察记录;注射用水验证报告没有各取样点的取样记录,验证报告不能全面反映各取样点情况。(第148条)(主要缺陷)40
(六)确认与验证无菌药品认证举例4:某公司注射用水系统采用回顾性确认,2011年对注射用永的微生物限度、pH值、电导率、TOC等项目进行了质量回顾,但<注射用水及循环系统再确认报告>(XX号)中仅有注射用水“微生物限度"项目的质量回顾情况,未包含PH值、电导率、TOC等项目的质量回顾情况。(第144条)41
(六)确认与验证无菌药品认证举例5:企业个别验证方法参数有待完善,如设备清洁残留用总有机碳检测法检测,用有机物的残留量代表药液残留状态;验证方案与报告未写明装载量、装载捧列方式,也未对灭菌柜布水方案和热传导的实验进行研究及验证;未对制塑瓶后待用暂存时间进行验。42
(七)文件管理本章节共有条款34条,现场检查发现缺陷项目所涉及的条款有279条,其中出现频次较高的缺陷项目内容涉及的条款为第175条、第170条、第180条、第182条,严重缺陷项目涉及的条款为第158条、第159条、第162条、第170条、第175条。主要存在问题:1.文件制定不合理、不完整,可操作性不强。2.记录填写不规范,如涂改不规范,内容填写不规范,监控、检验原始记录未签名等。43
(七)文件管理主要存在问题:3.批记录内容不完整,如缺少生产过程起止时间记录、生产过程操作记录、设备型号或编号、设备清洁方法及使用清洁剂的记录等。4.内控标准制定不详细,主要有缺少关键项目的内控指标、缺少中间产品的贮存条件。5.空白批记录的发放、复核未按程序控制;文件无受控号,受控管理效果不佳。6.仪器、设备使用记录管理不规范,如相关使用记录未存放于现场,使用记录未按日志管理等。44
(七)文件管理无菌药品认证举例:XX注射液(规格:XX批号:XX)批记录注射用水、纯化水压力指示分别为2.2MPa和1.4MPa,但记录均为0.18MPa(标准值);批生产记录中附有灭菌趋势图,但未附具体灭菌探头温度记录参数报表;灭菌柜进水、排水、活动探头的温控记录未纳入批生产记录管理;洗灌封记录未对焊盖温度参数进行记录。(第175条)45
(八)生产管理本章节共有条款33条,现场检查发现缺陷项目所涉及的条款有208条,其中出现频次较高的缺陷项目内容涉及的条款为第191条、第194条、第192条、第201条;主要缺陷项目涉及的条款为第184条。主要存在问题有:1.未按照工艺规程规定进行投料,投料记录不详细。2.生产使用的容器、设备等无状态标识或标识不规范。46
(八)生产管理主要存在问题:3.生产过程中防止污染和交叉污染措施不到位,清场不彻底,设备上残留有前批物料。4.未严格按照工艺规程规定操作或监控。5.生产过程中物料管理不规范,如生产过程中使用的有机溶剂其物料卡未标注批号、物料编号及检验状态。47
(八)生产管理无菌药品认证缺陷举例1:未严格按照《灌装运行处理制度》规定:有碎瓶时,一定要将碎瓶周围瓶子全部夹掉。但是现场动态时并未这样执行。(第184条)(主要缺陷)无菌药品认证缺陷举例2:对灌装岗位的异常情况,岗位质检人员未按偏差处理SOP规定要求进行调查和纠偏处理。(第195条)48
(八)生产管理无菌药品认证缺陷举例3:培养基灌装验证中数据显示使用西林瓶7780余支、培养基62500ml、乳糖2kg、胶塞和铝盖6780支,实际灌装6130支。批记录显示裂瓶数量为1530余支、培养基无剩余、乳糖剩余0.46kg、胶塞和铝盖600支,每支西林瓶灌装20mg乳糖+8ml培养基,各种物料使用数量与剩余、废弃数量不相吻合,未对产生的偏差进行充分分析。(附录1第47条)49
(九)质量控制与质量保证本章节共有条款61条,现场检查发现缺陷项目所涉及的条款有279条,其中出现频次较高的缺陷项目涉及条款为第223条、第226条、第222条;主要缺陷项目内容涉及的条款分别为第222条、第223条、第230条、严重缺陷项目内容涉及的条款为第223条、第230条。主要存在问题:1.实验室管理不规范。如(1)洁净度检查不规范;(2)对剩余检品或样品的处置无规定;(3)对照品标识不规范,未写明对照品来源和批号及配制过程,未定期标化;(4)含量测定对照品未进行平行试验等;(5)标准品未按规定条件贮存。50
(九)质量控制与质量保证主要存在问题:2.质量管理部门未对样品的接收、管理、发放建立制度3.检验原始记录内容不全。如(1)未记录使用仪器的型号/编号;(2)未记录具体的检验操作及环境温湿度;(3)未记录培养基、菌种、标准溶液、滴定液等的详细信息。(4)高效液相色谱图无复核人签名。4.偏差处理不到位。主要表现在偏差调查不及时、偏差描述不详细、原因分析不彻底或找不到根本原因,对产品质量的影响评估不到位,预防纠正措施不到位。51
(九)质量控制与质量保证主要存在问题:5.物料供应商评估内容不全。如评估内容缺少针对性,未包含产地和采收(加工)、产品稳定性考察等内容。6.企业初步建立变更控制系统,但针对变更进行的评估内容不全面。如原料药来源变更未进行充分评估;另部分文件变更未按变更控制程序管理。7.取样留样不规范。(1)操作规程缺少取样设备、取样位置、取样方法等内容,取样样品标签未标明贮存条件等;(2)中药材留样未注明产地:部分中药饮片未进行留样;留样未按规定条件贮存。52
(九)质量控制与质量保证主要存在问题:8.产品质量回顾分析不到位。主要表现在对环境监测数据未进行趋势分析、趋势分析未建立警戒线、对解决警戒线或内控标准的数据未进行原因分析。53
(九)质量控制与质量保证无菌药品认证缺陷举例:1.A级区定级时空气监测采样量不足,未达到1立方米。(附录1第9条)(主要缺陷)2.复方甘草酸苷注射液质量回顾分析内容不完整,如:没有对报告中万级、百级区微粒检测的异常数据进行分析;对连续4批成品的杂质偏离较大调查分析原因不准确,企业解释说偏离是由于原料杂质问题,但该批原料一直在使用,但以后的批次偏离较小;2011年成品回顾分析把新旧生产线成品批次放在一起分析,科学性不足。(第266条)(主要缺陷)54
(十)委托生产与委托检验本章节共有条款15条,现场检查发现缺陷项目所涉及的条款有7条,分别为第280条、第289条,均为一般缺陷,无主要缺陷。主要存在问题:1.未按规定对委托检验的受托方进行资质审核和评估。2.委托检验未备案,委托检验合同未明确规定取样地点。55
(十一)产品发运与召回本章节共有条款13条,现场检查发现缺陷项目所涉及的条款有3条,为一般缺陷,无主要缺陷,其中出现频次较高的缺陷项目涉及条款为第305条(4次)。主要存在问题:1.企业未定期对产品召回系统的有效性进行评估,未开展召回模拟演练。2.未制定模拟召回的操作记录。56
(十二)自检本章节共有条款5条,现场检查发现缺陷项目所涉及的条款有25条,主要为第309条(15次)、第307条(10次),均为一般缺陷,无主要缺陷。主要存在问题:1.未制订自检计划,没有自检过程的记录,无自检报告2.自检记录不规范;内容过于简单。3.自检流于形式,未对发现问题的整改落实情况进行跟踪检查、确认。未按新版GMP的要求将整改措施区分为纠正措施和预防措施,未对整改后效果进行评价。57'
您可能关注的文档
- 最新专项突破《16椭圆、双曲线、抛物线》剖析课件PPT.ppt
- 最新专题一和晋陵陆丞早春游望课件课件PPT.ppt
- 最新专题9-电流和电路资料课件PPT.ppt
- 最新专题-《狼》课件..课件PPT.ppt
- 最新专题三-图表信息问题课件PPT.ppt
- 最新专题五细胞呼吸课件分解课件PPT.ppt
- 最新世联-广州金地增城项目整体定位与发展战略综述课件PPT.ppt
- 最新东南亚(一课时)剖析课件PPT.ppt
- 最新两位数减一位数、整十数(退位)课件PPT.ppt
- 最新两课时只有一个地球PPT概述课件PPT.ppt
- 最新个案护理查房课件PPT.ppt
- 最新中兴BBURRU室分系统工程课件.课件PPT.ppt
- 最新中医儿科-猩红热课件PPT.ppt
- 最新中医内科学肺痈课件PPT.ppt
- 最新中医基础与辩证联合用药课件PPT.ppt
- 最新中医内科护理学(精)课件PPT.ppt
- 最新中医内科学课件第二章9.中风课件PPT.ppt
- 最新中医基础理论课件-第三章精气血津液神课件PPT.ppt