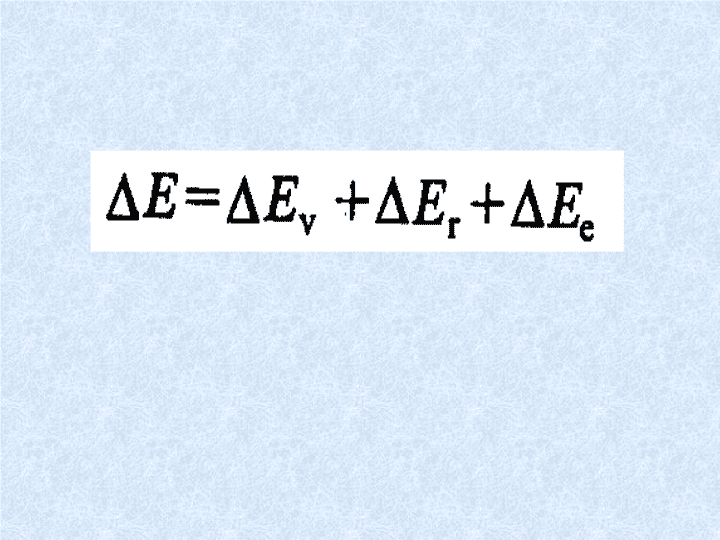- 1.53 MB
- 2022-04-29 14:22:44 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'化学键的振动频率
分子中基团的振动和转动能级跃迁产生:振-转光谱一、概述
近红外光区的吸收带(0.75-2.5µm)主要是由低能电子跃迁、含氢原子团(如O-H、N-H、C-H)伸缩振动的倍频吸收产生。该区的光谱可用来研究稀土和其它过渡金属离子的化合物,并适用于水、醇、某些高分子化合物以及含氢原子团化合物的定量分析。
中红外光区吸收带(2.5-25µm)是绝大多数有机化合物和无机离子的基频吸收带(由基态振动能级(=0)跃迁至第一振动激发态(=1)时,所产生的吸收峰称为基频峰)。由于基频振动是红外光谱中吸收最强的振动,所以该区最适于进行红外光谱的定性和定量分析。
同时,由于中红外光谱仪最为成熟、简单,而且目前已积累了该区大量的数据资料,因此它是应用极为广泛的光谱区。通常,中红外光谱法又简称为红外光谱法。
远红外光区吸收带(25-1000µm)是由气体分子中的纯转动跃迁、振动-转动跃迁、液体和固体中重原子的伸缩振动、某些变角振动、骨架振动以及晶体中的晶格振动所引起的。
由于低频骨架振动能灵敏地反映出结构变化,所以对异构体的研究特别方便。此外,还能用于金属有机化合物(包括络合物)、氢键、吸附现象的研究。但由于该光区能量弱,除非其它波长区间内没有合适的分析谱带,一般不在此范围内进行分析。
红外吸收光谱一般用T-曲线或T-(波数)曲线表示。纵坐标为百分透射比T%,因而吸收峰向下,向上则为谷;横坐标是波长(单位为µm),或(波数)(单位为cm-1)。
波长与波数之间的关系为:(波数)/cm-1=104/(/µm)中红外区的波数范围是4000-400cm-1。
二、红外光谱法的特点紫外、可见吸收光谱常用于研究不饱和有机物,特别是具有共轭体系的有机化合物,而红外光谱法主要研究在振动中伴随有偶极矩变化的化合物(没有偶极矩变化的振动在拉曼光谱中出现)。
因此,除了单原子和同核分子如Ne、He、O2、H2等之外,几乎所有的有机化合物在红外光谱区均有吸收。除光学异构体,某些高分子量的高聚物以及在分子量上只有微小差异的化合物外,凡是具有结构不同的两个化合物,一定不会有相同的红外光谱。
红外吸收带的波数位置、波峰的数目以及吸收谱带的强度反映了分子结构上的特点,可以用来鉴定未知物的结构组成或确定其化学基团;而吸收谱带的吸收强度与分子组成或化学基团的含量有关,可用以进行定量分析和纯度鉴定。
由于红外光谱分析特征性强,气体、液体、固体样品都可测定,并具有用量少,分析速度快,不破坏样品的特点。因此,红外光谱法不仅与其它许多分析方法一样,能进行定性和定量分析,而且是鉴定化合物和测定分子结构的用效方法之一。
红外光谱图:纵坐标为吸收强度,横坐标为波长λ(μm)和波数1/λ单位:cm-1可以用峰数,峰位,峰形,峰强来描述。应用:有机化合物的结构解析。定性:基团的特征吸收频率;定量:特征峰的强度;二、红外光谱与有机化合物结构
满足两个条件:1.辐射应具有能满足物质产生振动跃迁所需的能量;2.辐射与物质间有相互偶合作用。对称分子:没有偶极矩,辐射不能引起共振,无红外活性。如:N2、O2、Cl2等。非对称分子:有偶极矩,红外活性。偶极子在交变电场中的作用示意图(一)红外光谱产生的条件一
分子的振动能级(量子化):E振=(V+1/2)hV:化学键的振动频率;:振动量子数。1.双原子分子的简谐振动及其频率化学键的振动类似于连接两个小球的弹簧(二)分子振动方程式
任意两个相邻的能级间的能量差为:K化学键的力常数,与键能和键长有关,为双原子的折合质量=m1m2/(m1+m2)发生振动能级跃迁需要能量的大小取决于键两端原子的折合质量和键的力常数,即取决于分子的结构特征。分子振动方程式
表某些键的伸缩力常数(毫达因/埃)键类型—CC—>—C=C—>—C—C—力常数15179.59.94.55.6峰位4.5m6.0m7.0m化学键键强越强(即键的力常数K越大)原子折合质量越小,化学键的振动频率越大,吸收峰将出现在高波数区。
例题:由表中查知C=C键的K=9.59.9,令其为9.6,计算波数值正己烯中C=C键伸缩振动频率实测值为1652cm-1
一、产生红外吸收的条件1.辐射光子具有的能量与发生振动跃迁所需的跃迁能量相等红外吸收光谱是分子振动能级跃迁产生的。因为分子振动能级差为0.05~1.0eV,比转动能级差(0.00010.05eV)大,因此分子发生振动能级跃迁时,不可避免地伴随转动能级的跃迁,因而无法测得纯振动光谱,但为讨论方便,以双原子分子振动光谱为例,说明红外光谱产生的条件。第二节基本原理
若把双原子分子(A-B)的两个原子看作两个小球,把连结它们的化学键看成质量可以忽略不计的弹簧,则两个原子间的伸缩振动,可近似地看成沿键轴方向的间谐振动。
由量子力学可以证明,该分子的振动总能量(E)为:E=(+1/2)h(=0,1,2,)式中为振动量子数(=0,1,2,…);E是与振动量子数相应的体系能量;为分子振动的频率。
在室温时,分子处于基态(=0),E=1/2h,此时,伸缩振动的频率很小。当有红外辐射照射到分子时,若红外辐射的光子(L)所具有的能量(EL)恰好等于分子振动能级的能量差(△Ev)时,则分子将吸收红外辐射而跃迁至激发态,导致振幅增大。
分子振动能级的能量差为△Ev=△h又光子能量为EL=hL于是可得产生红外吸收光谱的第一条件为:EL=△Ev即L=△
因此,只有当红外辐射频率等于振动量子数的差值与分子振动频率的乘积时,分子才能吸收红外辐射,产生红外吸收光谱。分子吸收红外辐射后,由基态振动能级(=0)跃迁至第一振动激发态(=1)时,所产生的吸收峰称为基频峰。因为△=1时,L=,所以基频峰的位置(L)等于分子的振动频率。
在红外吸收光谱上除基频峰外,还有振动能级由基态(=0)跃迁至第二激发态(=2)、第三激发态(=3),所产生的吸收峰称为倍频峰。=0跃迁至=2时,(振动量子数的差值)△=2,则L=2,即吸收的红外线谱线(L)是分子振动频率的二倍,产生的吸收峰称为二倍频峰。
由=0跃迁至=3时,(振动量子数的差值)△=3,则L=3,即吸收的红外线谱线(L)是分子振动频率的三倍,产生的吸收峰称为三倍频峰。其它类推。在倍频峰中,二倍频峰还比较强。三倍频峰以上,因跃迁几率很小,一般都很弱,常常不能测到。
基频峰(0→1)2885.9cm-1最强二倍频峰(0→2)5668.0cm-1较弱三倍频峰(0→3)8346.9cm-1很弱四倍频峰(0→4)10923.1cm-1极弱五倍频峰(0→5)13396.5cm-1极弱由于分子非谐振性质,各倍频峰并非正好是基频峰的整数倍,而是略小一些。以HCl为例:
除此之外,还有合频峰(1+2,21+2,),差频峰(1-2,21-2,)等,这些峰多数很弱,一般不容易辨认。倍频峰、合频峰和差频峰统称为泛频峰。
2辐射与物质之间有耦合作用为满足这个条件,分子振动必须伴随偶极矩的变化。红外跃迁是偶极矩诱导的,即能量转移的机制是通过振动过程所导致的偶极矩的变化和交变的电磁场(红外线)相互作用发生的。分子由于构成它的各原子的电负性的不同,也显示不同的极性,称为偶极子。通常用分子的偶极矩()来描述分子极性的大小。
当偶极子处在电磁辐射电场时,该电场作周期性反转,偶极子将经受交替的作用力而使偶极矩增加或减少。由于偶极子具有一定的原有振动频率,显然,只有当辐射频率与偶极子频率相匹时,分子才与辐射相互作用(振动耦合)而增加它的振动能,使振幅增大,即分子由原来的基态振动跃迁到较高振动能级。
因此,并非所有的振动都会产生红外吸收,只有发生偶极矩变化(△≠0)的振动才能引起可观测的红外吸收光谱,该分子称之为红外活性的;△=0的分子振动不能产生红外振动吸收,称为非红外活性的。
当一定频率的红外光照射分子时,如果分子中某个基团的振动频率和它一致,二者就会产生共振,此时光的能量通过分子偶极矩的变化而传递给分子,这个基团就吸收一定频率的红外光,产生振动跃迁。
如果用连续改变频率的红外光照射某样品,由于试样对不同频率的红外光吸收程度不同,使通过试样后的红外光在一些波数范围减弱,在另一些波数范围内仍然较强,用仪器记录该试样的红外吸收光谱,进行样品的定性和定量分析。
二、双原子分子的振动分子中的原子以平衡点为中心,以非常小的振幅(与原子核之间的距离相比)作周期性的振动,可近似的看作简谐振动。这种分子振动的模型,以经典力学的方法可把两个质量为m1和m2的原子看成钢体小球,连接两原子的化学键设想成无质量的弹簧,弹簧的长度r就是分子化学键的长度。
由经典力学可导出该体系的基本振动频率计算公式式中k为化学键的力常数,定义为将两原子由平衡位置伸长单位长度时的恢复力(单位为Ncm-1)。
单键、双键和三键的力常数分别近似为5、10和15Ncm-1;c为光速(2.9981010cms-1),为折合质量,单位为g,且根据小球的质量和相对原子质量之间的关系,上式可写成:Ar为折合相对原子质量。
影响基本振动频率的直接原因是相对原子质量和化学键的力常数。化学键的力常数k越大,折合相对原子质量Ar越小,则化学键的振动频率越高,吸收峰将出现在高波数区;反之,则出现在低数区。
例如C–C、CC、CC三种碳碳键的质量相同,键力常数的顺序是三键>双键>单键。因此在红外光谱中,CC的吸收峰出现在2222cm-1,而CC约在1667cm-1,C-C在1429cm-1。
对于相同化学键的基团,波数与相对原子质量平方根成反比。例如C-C、C-O、C-N键的力常数相近,但相对折合质量不同,其大小顺序为C-C100非常强峰(vs)20<<100强峰(s)10<<20中强峰(m)1<<10弱峰(w)
1.两类基本振动形式伸缩振动亚甲基:三、分子中基团的基本振动形式
变形振动亚甲基
例1 水分子2.峰位、峰数与峰强(1)峰位化学键的力常数K越大,原子折合质量越小,键的振动频率越大,吸收峰将出现在高波数区(短波长区);反之,出现在低波数区(高波长区)。(2)峰数峰数与分子自由度有关。无瞬间偶基距变化时,无红外吸收。
峰位、峰数与峰强例2CO2分子(4)由基态跃迁到第一激发态,产生一个强的吸收峰,基频峰;(5)由基态直接跃迁到第二激发态,产生一个弱的吸收峰,倍频峰;(3)瞬间偶基距变化大,吸收峰强;键两端原子电负性相差越大(极性越大),吸收峰越强;
1.内部因素(1)电子效应a.诱导效应:吸电子基团使吸收峰向高频方向移动(兰移)化学键的振动频率不仅与其性质有关,还受分子的内部结构和外部因素影响。相同基团的特征吸收并不总在一个固定频率上。四、影响峰位变化的因素
cm-1cm-1cm-1cm-1b.共轭效应:R-CORC=01715cm-1;R-COHC=01730cm-1;R-COClC=01800cm-1;R-COFC=01920cm-1;F-COFC=01928cm-1;R-CONH2C=01920cm-1;
CHCHCHCH1576cm-11611cm-11644cm-11781cm-11678cm-11657cm-11651cm-12222CH3060-3030cm-12900-2800cm-1(2)空间效应
(2)空间效应:场效应;空间位阻;环张力(3)氢键效应(分子内氢键;分子间氢键):对峰位,峰强产生极明显影响,使伸缩振动频率向低波数方向移动。影响峰位变化的因素
一、红外光谱的特征性二、有机化合物分子中常见基团吸收峰三、基团吸收带数据四、分子的不饱和度第三节红外光谱与分子结构
与一定结构单元相联系的、在一定范围内出现的化学键振动频率——基团特征频率(特征峰);例:28003000cm-1—CH3特征峰;16001850cm-1—C=O特征峰;基团所处化学环境不同,特征峰出现位置变化:—CH2—CO—CH2—1715cm-1酮—CH2—CO—O—1735cm-1酯—CH2—CO—NH—1680cm-1酰胺一、红外光谱的特征性
常见的有机化合物基团频率出现的范围:4000670cm-1依据基团的振动形式,分为四个区:1.40002500cm-1X—H伸缩振动区(X=O,N,C,S)2.25001900cm-1三键,累积双键伸缩振动区3.19001200cm-1双键伸缩振动区4.1200670cm-1X—Y伸缩,X—H变形振动区红外光谱与分子结构
二、有机化合物分子中常见基团吸收峰1.X—H伸缩振动区(40002500cm-1)(1)—O—H36503200cm-1确定醇,酚,酸在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐,强吸收;当浓度较大时,发生缔合作用,峰形较宽。
(3)不饱和碳原子上的=C—H(C—H)苯环上的C—H3030cm-1=C—H30102260cm-1C—H3300cm-1(2)饱和碳原子上的—C—H3000cm-1以上—CH32960cm-1反对称伸缩振动2870cm-1对称伸缩振动—CH2—2930cm-1反对称伸缩振动2850cm-1对称伸缩振动—C—H2890cm-1弱吸收3000cm-1以下
2.双键伸缩振动区(12001900cm-1)苯衍生物在16502000cm-1出现C-H和C=C键的面内变形振动的泛频吸收(强度弱),可用来判断取代基位置。(1)RC=CR’16201680cm-1强度弱,R=R’(对称)时,无红外活性。(2)单核芳烃的C=C键伸缩振动(16261650cm-1)
(3)C=O(18501600cm-1)碳氧双键的特征峰,强度大,峰尖锐。醛,酮的区分?
3.叁键(CC)伸缩振动区(25001900cm-1)4.X—Y,X—H变形振动区<1650cm-1指纹区(1350650cm-1),较复杂。C-H,N-H的变形振动;C-O,C-X的伸缩振动;C-C骨架振动等。精细结构的区分。(1)RCCH(21002140cm-1)RCCR’(21902260cm-1)R=R’时,无红外活性(2)RCN(21002140cm-1)非共轭22402260cm-1共轭22202230cm-1
三、基团吸收带数据
常见基团的红外吸收带特征区指纹区500100015002000250030003500C-H,N-H,O-HN-HCNC=NS-HP-HN-ON-NC-FC-XO-HO-H(氢键)C=OC-C,C-N,C-O=C-HC-HCCC=C
四、分子的不饱和度定义:不饱和度是指分子结构中达到饱和所缺一价元素的“对”数。如:乙烯变成饱和烷烃需要两个氢原子,不饱和度为1。计算:若分子中仅含一,二,三,四价元素(H,O,N,C),则可按下式进行不饱和度的计算:=(2+2n4+n3–n1)/2n4,n3,n1分别为分子中四价,三价,一价元素数目。作用:由分子的不饱和度可以推断分子中含有双键,三键,环,芳环的数目,验证谱图解析的正确性。例:C9H8O2=(2+29–8)/2=6
一、仪器类型与结构二、制样方法三、联用技术第四节
红外分光光度计
一、仪器类型与结构两种类型:色散型干涉型(付立叶变换红外光谱仪)
内部结构Nicolet公司的AVATAR360FT-IR
傅里叶变换红外光谱仪结构框图干涉仪光源样品室检测器显示器绘图仪计算机干涉图光谱图FTS
傅里叶变换红外光谱仪工作原理图
迈克尔干涉仪工作原理图
二、制样方法1)气体——气体池2)液体:①液膜法——难挥发液体(BP》80C)②溶液法——液体池溶剂:CCl4,CS2常用。3)固体:①研糊法(液体石腊法)②KBR压片法③薄膜法
三、联用技术GC/FTIR(气相色谱红外光谱联用)LC/FTIR(液相色谱红外光谱联用)PAS/FTIR(光声红外光谱)MIC/FTIR(显微红外光谱)——微量及微区分析
一、红外谱图解析示例二、未知物结构确定第五节
红外谱图解析示例
一、红外谱图解析示例1.烷烃
2.烯烃
对比烯烃顺反异构体
3.醇氢键缔合
4.醛、酮
5.羧酸及其衍生物
二、未知物结构确定未知物1
红外光谱法应用1有机化合物结构分析1目标化合物验证·样品制备·做红外光谱图·查红外标准谱图
萨特勒红外标准谱theSadtelerstandardspectra,IR索引:分子组成式C,H,O,N化合物名称
2.未知物定性分析谱图解析方法·根据分子式(如果有)计算不饱和度·根据吸收峰确定官能团·根据官能团和分子式,给出可能的结构·根据其他信息给出最终结构式
谱图解析例1某化合物分子式为C4H8O2谱图如下求结构
·3000cm-1CH2,CH3·1740cm-1C=0·1470CH2·1375CH3·1239C-O-C解释
可能的结构C2H5CH3COOHCOOC3H7C2H5CCH3OO
最后判断:①查标准谱图sadtler标准谱图②用标准样品③进一步分析谱图或借助其他信息
谱图解析例2某化合物分子式为C8H10谱图如下求结构
血站血液检测项目
及各检测项目的意义109
根据中华人民共和国国家标准GB18467-2001献血者健康检查要求,保证献血者的身体健康和受血者的输血安全。对献血者血液检验要求做了规定,主要包括以下七项内容:110
血红蛋白检测血型检测(ABO血型检测和RhD血型检测)丙氨酸氨基转移酶检测(ALT)乙型肝炎病毒表面抗原检测(HBsAg)丙型肝炎病毒抗体检测(HCV抗体)艾滋病病毒抗体检测(HIV抗体)梅毒螺旋体抗体检测(TP)111
下面就分别介绍这七个检测项目如下:一、血红蛋白检测:方法:1、硫酸铜法2、血红蛋白分析仪检测法标准:1、硫酸铜法:男≥1.0520女≥1.05002、血红蛋白分析仪检测法:男≥120g/l女≥110g/l112
意义:1、保证献血者健康的要求:通过血红蛋白的检测可以反映献血者的血红蛋白水平是否符合献血要求,因为献血本身就是一个失血的过程,如果让一个本身就贫血的人去献血的话,就会给献血者的身体造成更大的损害,所以说血红蛋白检测是保证献血者健康的要求。113
2、保证血液质量的要求:这一点从何说起呢?《全血及成分血质量要求》中有这样一项规定:血细胞比容(压实红细胞占全血的百分比):ACD方≥0.30CPD方≥0.35(125g/l相当于0.38)采集的血液加上保养液,如果是贫血的话,血细胞比容很难达到上述要求,所以说血红蛋白检测是保证血液质量的要求。114
二、血型检测(ABO血型检测和RhD血型检测)方法:1、试管法2、玻片法(纸板法)3、微柱凝胶血型卡法(临床上用的较多)标准:ABO及Rh血型相符意义:正确鉴定血型,保证用血者同型输血,保证输血安全。115
三、丙氨酸氨基转移酶检测(ALT)方法:1、酮体粉法(仅限于初检使用)2、赖氏法3、速率法标准:1、酮体粉法:阴性2、赖氏法:≤25单位3、速率法:≤40单位116
意义:1、肝胆疾病传染性肝炎、肝癌、中毒性肝炎、脂肪肝和胆管炎待等。2、心血管疾病心肌梗死、心肌炎、心力衰竭时肝淤血和脑出血等。3、药物和毒物氯丙嗪、异菸肼、奎宁、水杨酸制剂及乙醇,铅、汞、四氯化碳或有机磷等。4、创伤、运动、饮酒、疲劳等多种原因。5、在检测过程中,血样的运输、保存、温度等多种条件也可以引起ALT的升高。117
四、乙型肝炎病毒表面抗原检测(HBsAg)方法:1、胶体金法(初筛时使用)2、放射免疫法(因有放射污染,已很少用)3、酶联免疫法(采供血单位使用)4、化学发光法(临床在用,成本较高)标准:阴性意义:1、急性乙肝2、慢性乙肝3、无症状携带者118
五、丙型肝炎病毒抗体检测(HCV抗体)方法:1、重组免疫印迹试验测定HCV-IgG抗体(确认试验)2、ELISA法测定HCV-IgG抗体标准:阴性119
意义:丙型肝炎病毒(HCV)是输血后肝炎和散发性非甲非乙型肝炎的主要病原。HCV感染后,可导致慢性肝炎、肝硬化和肝细胞癌等多种肝脏疾病。现在用的ELISA法测定HCV-IgG抗体,主要用于献血员的HCV感染筛查和临床实验室检测,抗HCV检测阳性提示感染过HCV;对大部分病例而言,抗HCV阳性常伴有HCVRNA的存在。因此,抗HCV是判断HCV感染的一个重要标志。抗HCV阳性而血清中没有HCVRNA提示既往感染。有极少数病例HCV阴性仍可检测到HCVRNA。另外,某些慢性HCV感染者的抗HCV可持续存在。120
六、艾滋病病毒抗体检测(HIV抗体)方法:1、乳胶颗粒凝集试验测定抗HIV抗体(初筛时使用)2、ELISA法测定抗HIV抗体(采供血单位使用)3、免疫印迹法测定抗HIV抗体(确认试验)标准:阴性121
意义:抗HIV抗体阳性提示如下1、感染了HIV,可作为传染源将HIV传播他人。2、抗HIV阳性者(除外18个月的婴儿),5年之内将有10%~30%的人发展为艾滋病。3、对抗HIV阳性的母亲所生婴儿,如18个月内检测血清抗HIV阳性,不能诊断为HIV感染,尚需用HIV核酸检测或18个月后的血清抗体检测来判断。122
七、梅毒螺旋体抗体检测(TP)方法:1、甲苯胺红不加热血清试验(TRUST)2、ELISA法测定抗梅毒螺旋体(TP)抗体(采供血单位使用)3、密螺旋体颗粒凝集试验(TPPA)测定抗TP抗体4、金标记免疫层析测定抗TP抗体(初筛时使用)标准:阴性123
意义:1、甲苯胺红不加热血清试验(TRUST),为非特异性试验,阴性结果不能排除梅毒感染,阳性结果需进一步做抗梅毒螺旋体抗体试验确认。2、梅毒的血清学试验阳性,只提示所测标本中有抗类脂抗体或抗TP抗体存在,不能作为患者感染梅毒螺旋体的绝对依据,阴性结果也不能排除梅毒螺旋体感染,检测结果应结合临床综合分析。124
引起ELISA试验假阳性或假阴性结果的主要标本因素:125
1、内源性物质由于一些人体内含有内源性物质,可以不同程度地影响检测结果。常见的内源性物质有:类风湿因子、补体、嗜异性抗体、嗜靶抗原的自身抗体、高免疫球蛋白血、超氧化物歧化酶、交叉反应物质和其它的物质等。另外,标本中脂质过高、胆红素、血红蛋白等,均对ELISA检测结果有干扰作用。126
2、外源性物质外源性物质常常是由于标本采集、运输或贮存不当所致。如标本溶血、细菌污染、贮存不当、凝集不全、抗凝剂等的影响。127
(1)标本溶血各种原因引起的标本溶血,均会因红细胞破坏溶解时释放出大量具有过氧化物酶活性的血红蛋白,在以辣根过氧化物酶为标记物的ELISA检测中,会导致非特性显色,从而造成假阳性结果,因此,在标本采集、运输或贮存过程中要尽量避免标本溶血。128
(2)细菌污染一此菌体中可能含有内源性过氧化物酶,可能会干扰检测,因此,在标本采集、运输或贮存过程中要尽量避免标本被细菌污染。129
(3)贮存不当在冰箱中贮存时间过长的标本,血清中的IgG可聚合成多聚体、AFP可形成二聚体,在间接法ELISA检测中可导致本底过高,造成假阳性结果;标本贮存时间过长,有时抗原或抗体的免疫活性减弱,也可造成假阴性结果。为了避免上述干扰,ELISA检测的标本最好为新鲜采集,如不能立即检测,5天内检测的标本需分离出血清或血浆,于4℃冰箱中贮存,1周后检测的标本要低温冰冻贮存。130
(4)凝集不全标本在采集后,需要一定时间的凝集,才可以分离出血清。在实际工作中,为了争取快速检测,常在标本未完全凝集时开始分离,使血清中含有纤维蛋白原,在ELISA检测过程中形成肉眼可见的纤维蛋白凝块,造成假阳性结果,这类标本在完全凝集后复查时变为阴性结果。为了避免上述干扰,这类标本要在完全凝集后在进行检测或采集时加入促凝剂。131
(5)抗凝剂为了快速进行检测,常在标本采集时加入一些抗凝剂,得到血浆进行检测。常用抗凝剂有肝素、EDTA、枸橼酸钠等,这些抗凝剂均会对ELISA检测存在一定的干扰。为了避免上述干扰,在进行检测时应根据检测目的选择合适的抗凝剂。(用肝素作为抗凝剂对ELISA检测影响较大)132
综上所述,影响ELISA检测的因素很多,因此,仅凭ELISA检测不能进行诊断,只能为临床诊断提供依据。结合我站的实际工作情况,对献血员进行解释时,一定要注意分寸,建议献血员去医院结合临床进行诊断。133'
您可能关注的文档
- 最新劳动法课件PPT.ppt
- 最新劳动最光荣ppt..课件PPT.ppt
- 最新勤奋好学我争先课件PPT.ppt
- 最新勺子里的哈哈镜课件PPT.ppt
- 最新化学品供应系统介绍全解课件PPT.ppt
- 最新化学能与电能(动画)概要课件PPT.ppt
- 最新化学电源ppt课件PPT.ppt
- 最新化工原理-19对流传热机理和对流传热系数..课件PPT.ppt
- 最新化工仪表及其自动化(精)课件PPT.ppt
- 最新化学键与物质类别ppt课件PPT课件.ppt
- 最新化工设计概论与化工制图课件--第六章-设备的选型及其工艺设计课件PPT.ppt
- 最新北京---明十三陵模板课件PPT.ppt
- 最新北京大学电分析课件电极电解质溶液界面上的双电层课件PPT.ppt
- 最新北京教育科学研究院基础教育基地教学研究中心高一化学教师培训资料课件-人教版必修1课件PPT.ppt
- 最新北师大图书馆学基础chapter1课件PPT.ppt
- 最新北宋建立及其制度创设(精)课件PPT.ppt
- 最新北师大版二年级数学下册《回收废电池》课件PPT版课件ppt.ppt
- 最新北师大必修一unit3-lesson4-christmas课件PPT.ppt