- 1.54 MB
- 2022-04-29 14:19:29 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'2电化学腐蚀原理热力学部分0506
电化学腐蚀是金属材料腐蚀现象中最为常见的一种形式电化学腐蚀基本概念:金属材料与电解质溶液相互接触时,在固液相界面上发生有电子参加的氧化还原反应,使界面处的金属变成金属离子、络合离子或氢氧化物和氧化物等,从而破坏了金属的性能。需要注意以下两点概念:1电化学腐蚀是腐蚀电池电极反应的结果2电化学腐蚀的本质是形成了腐蚀电池
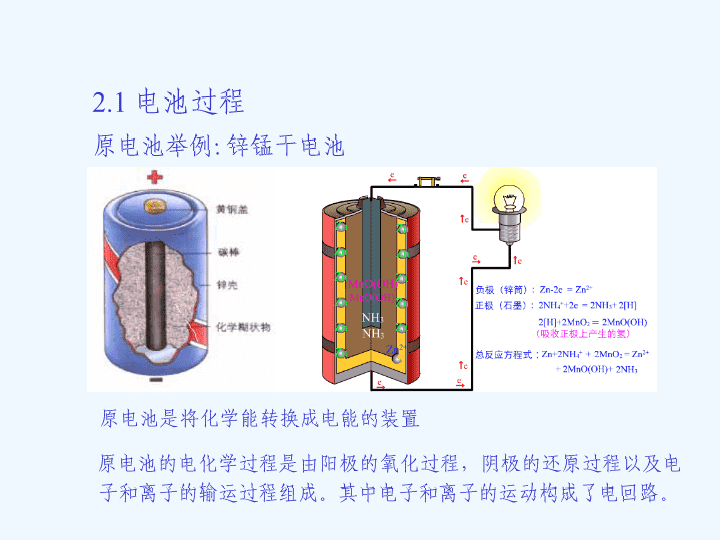
2.1电池过程原电池举例:锌锰干电池原电池是将化学能转换成电能的装置原电池的电化学过程是由阳极的氧化过程,阴极的还原过程以及电子和离子的输运过程组成。其中电子和离子的运动构成了电回路。
阳极阴极电解质溶液(*)电池反应的推动力-电池两个电极的电位差构成腐蚀原电池的基本要素(*)腐蚀原电池产生的电流是由于它的两个电极在电解质中的电位不同产生的电位差引起的,该电位差是电池反应的推动力
E0=-0.44VE0=1.23V腐蚀微电池—盐水滴实验(***)*铁钉实验(练习)
腐蚀原电池类型1.宏观腐蚀电池——电极尺寸相对较大(肉眼可以分辨阴极和阳极)微观腐蚀电池——电极尺寸微小根据构成腐蚀电池的电极尺寸大小,可以把腐蚀电池分为两类:
宏观腐蚀电池1.异种金属相接触如电偶腐蚀2.浓差电池(1)金属离子浓度不同,浓度低电位低,容易腐蚀(2)氧浓度不同氧浓度低电位低,更容易腐蚀3.温差电池如金属所处环境温度不同,高温电位低,更容易腐蚀铜铆钉铝板沙土粘土
微观腐蚀电池(1)材料本身的不均匀性化学成分不均匀组织结构不均匀
微观腐蚀电池金属表面的物理状态不均匀金属表面膜的不完整
(2)液相不均匀性离子浓度(质子或氧离子浓度)(3)系统外界条件不均匀性温差、光照等分布不均匀
2.2电极与电极电位电极的概念——电子导体(金属等)与离子导体(电解质)相互接触,并有电子在两相之间迁移而发生氧化还原反应的体系。电极电极一般分为单电极和多重电极单电极是指电极的相界面上发生唯一的电极反应多重电极则可能发生多个电极反应
单电极(1)金属电极金属在含有自己离子的溶液中构成的电极(2)气体电极某些贵金属在不含有自己离子的溶液中,它们既不能以离子形式进入到溶液中去,溶液中也没有能沉积到电极上的物质,只有溶于溶液中的一些气体吸附到电极上,并使气体离子化,电极上只有电子交换,没有离子交换,这类电极叫气体电极。常用的气体电极包括,氢电极、氧电极和氯电极等
(3)氧化还原电极/惰性金属电极金属/溶液街面上只有电子可以交换,只有电子可迁越相界面的一种金属电极。例如:将Pt置于FeCl3溶液中,将存在下列反应平衡,并有一定的电位,被称为氧化还原电位。
多重电极在一个电极上同时发生两个或两个以上的电极反应,多重电极是一种非平衡电极。例如:将Zn片插入盐酸溶液中,在锌片电极上可发生两个电极反应,该过程为双重电极
参比电极参比电极应该满足以下几个条件:电极反应是可逆的;电位稳定而不随时间变化;交换电流密度大,不极化或难极化;参比电极内部溶液与腐蚀介质互不渗污,溶液界面电位小;温度系数小。常见的参比电极有:标准氢电极;饱和甘汞电极;氯化银电极;铜/硫酸铜电极。
标准氢电极(SHE)(E=0.00V)(Pt(镀铂黑)H2(1atm),H+(aH+=1))标准氢电极的电极反应为(Pt)H2=2H++2e规定标准氢电极的电位为零。以标准氢电极为参考电极测出的电位值称为氢标电位,记为E(vsSHE)。SHE是最基准的参考电极,但使用不方便,实验室中常用的参考电极有:饱和甘汞电位(记为SCE),银-氯化银电极等。
饱和KCl甘汞参比电极(E=0.24V)铜/硫酸铜参比电极(E=0.318V)Hg/Hg2Cl2,KCl(1mol/L)Cu/CuSO4(饱和)
电极电位电极反应导致在金属和溶液的界面上形成双电层,双电层两侧的电位差,即金属与溶液间产生的电位差构成了所谓电极电位,也称绝对电极电位。也可以简单地说,绝对电极电位是电子导体和离子导体接触时的界面电位差
当参与电极反应物质的活度(溶液)或逸度(气体)为1时,此时的电极电位被称之为标准电极电位。由于绝对电极电位无法测得,只有通过测量电池电动势的方法测出“相对电极电位”。通常选择合适的参比电极与被测电极组成原电池,测量其电动势,习惯称之为被测电极的电极电位。标准电极电位只是温度和压力的函数。通常我们将298.15K和1.01*105Pa(1atm)作为标准状态。一般的标准电极电位都是指这样的温度和压力下的数值。电极电位
K=K++eNa=Na++eMg=Mg2++2eAl=Al3++3eTi=Ti2++2eMn=Mn2++2eCr=Cr2++2eZn=Zn2++2eCr=Cr3++3eFe=Fe2++2eCd=Cd2++2eMn=Mn3++3eCo=Co2++2e-2.925-2.714-2.37-1.66-1.63-1.18-0.913-0.762-0.74-0.440-0.402-0.283-0.277Ni=Ni2++2eMo=Mo3++3eSn=Sn2++2ePb=Pb2++2eFe=Fe3++3eH2=2H++2eCu=Cu2++2eCu=Cu++e2Hg=Hg22++2eAg=Ag++eHg=Hg2++2ePt=Pt2++2eAu=Au3++3e-0.250-0.2-0.136-0.126-0.0360.000+0.337+0.521+0.189+0.799+0.854+1.19+1.50金属在25℃时的标准电极电位e(V,SHE)电极反应电极反应e,伏e,伏第一节电极电位
双电层结构模型主要有以下三种(P20)(1)紧密型(赫姆霍兹模型)只适用于溶液离子浓度很大或者电极表面电荷密度很大的情况。(2)分散型(古伊-奇普曼模型)对紧密型的扩展(分子热运动原理)(3)紧密+分散型(斯特恩模型)对前两者的结合
金属材料在电解质溶液中形成双电层
平衡电极电位和非平衡电极电位当金属电极上只有一个确定的电极反应,并且该反应处于动态平衡,即金属的溶解速度等于金属离子的沉积速度,在此平衡电极过程中,电极获得一个不变的电位值,该值被称为平衡电极电位(可逆电极电位)。平衡电极电位*思考题:平衡电极电位和标准电极电位的区别(作业)电荷平衡:ia=ic物质平衡:M=Mn+Fe2+FeFeFe2+
实际腐蚀过程中电极上通常同时存在多种物质参与电化学反应,电极上不可能出现物质交换与电荷交换均达到平衡的情况,此时的电极电位为非平衡电极电位。(*)非平衡电极电位可以是稳定的也可以是不稳定的阳极反应FeFe2++2e(ia)阴极反应2H++2eH2(ic)即ia=ic但FeFe2++2eHH++e非平衡电位特点:电荷平衡,物质不平衡不满足Nernst关系只能通过实验获得Fe2+FeFeFe2+H22H+H22H+非平衡电极电位
2.3腐蚀过程热力学判据问题???(1)材料在环境中是否发生腐蚀?(2)腐蚀的倾向有多大?如何判断腐蚀的倾向?
基本概念G=-nEF可逆电池的电动势与电池反应自由焓的关系化学位电化学位(公式推导见材料腐蚀与防护(李晓刚)P26)自学
能斯特方程:能斯特方程反映了:电池的电动势受温度、电池中的反应物和产物的活度或压强影响的关系,它们的变化可以改变电动势的大小,甚至其浓度的变化可以导致腐蚀倾向的改变。
能斯特生平:德国物理化学家23岁博士,27岁教授,68岁皇家学会会员由于纳粹政权的迫害,69岁退休,在农村度过晚年能斯特方程;引入浓度积这个重要概念提出光化学的“原子链式反应”理论;热力学第三定律研制出含氧化锆及其氧化物发光剂的白炽电灯设计出用指示剂测定介电常数、离子水化度和酸碱度的方法发展了分解和接触电势,钯电极性状和神经刺激理论1920年诺贝尔化学奖
能斯特方程练习:(1)Fe=Fe2++2e(2)2Fe2++3H2O=Fe2O3+6H++2e(3)3Fe2++4H2O=Fe3O4+8H++2e
电化学腐蚀热力学判据(1)腐蚀反应自由能变化与腐蚀倾向(自由能准则)对于任何一个化学反应,反应总是自发地向自由能降低的方向进行,如aA+bBcC+dD<0自发进行(|G|愈大,自发倾向愈大)=0平衡反应>0不能自发进行
金属在电解质水溶液中发生电化学腐蚀的原因是:金属和电解质溶液构成了热力学不稳定体系,发生腐蚀反应使体系的自由能减小。自由能减小愈多,体系的腐蚀倾向愈大。自由能的变化不仅与金属有关,而且与溶液中参与反应的各组分的活度(或分压)及溶液温度有关。金属氧化反应的产物不同,自由能变化G也不同。Zn+2H+Zn2++H2G=-35KcalNi+2H+Ni2++H2G=-11KcalAu+3H+Au3++3/2H2G=+104KcalCu+2H+Cu2++H2G=+15KcalCu+1/2O2+2H+Cu2++H2OG=-41Kcal
(2)标准电极电位与腐蚀倾向(电位准则)E0>0或ec>ea判断电化学腐蚀倾向的电位比较准则:如果金属发生氧化反应的平衡电位ea低于溶液中某种氧化剂(即去极化剂)发生还原反应的平衡电位ec,则电化学腐蚀能够发生。二者的差值(ec-ea)愈大,腐蚀的倾向愈大。*电动序的局限性多数金属在实际情况下,通常被一层氧化膜覆盖,氧化膜的致密性和完整性的程度对金属的腐蚀行为影响非常显著。*混合电位?
K=K++eNa=Na++eMg=Mg2++2eAl=Al3++3eTi=Ti2++2eMn=Mn2++2eCr=Cr2++2eZn=Zn2++2eCr=Cr3++3eFe=Fe2++2eCd=Cd2++2eMn=Mn3++3eCo=Co2++2e-2.925-2.714-2.37-1.66-1.63-1.18-0.913-0.762-0.74-0.440-0.402-0.283-0.277Ni=Ni2++2eMo=Mo3++3eSn=Sn2++2ePb=Pb2++2eFe=Fe3++3eH2=2H++2eCu=Cu2++2eCu=Cu++e2Hg=Hg22++2eAg=Ag++eHg=Hg2++2ePt=Pt2++2eAu=Au3++3e-0.250-0.2-0.136-0.126-0.0360.000+0.337+0.521+0.189+0.799+0.854+1.19+1.50金属在25℃时的标准电极电位e(V,SHE)电动序EFS电极反应电极反应e,伏e,伏第一节电极电位
试问金属铁和铜在下列溶液中的腐蚀情况:1在25℃的酸性水溶液中,水中从未含有任何金属离子?2在25℃的盐酸水溶液中(盐酸活度为1)?3在25℃含氧的酸性水溶液中?例题:(1)Fe=Fe2++2eCu=Cu2++2e(2)Cu+2Cl-=CuCl-2+e(3)O2+2H2O+4e=4OH-
2.4电位-pH图原理金属电极电位不仅与溶液中金属离子的浓度有关,也与pH值有关。以电位e为纵坐标,pH为横坐标,将电极电位-pH值平衡关系表示在图上,据此可绘制电位—pH平衡图,又称布拜(Pourbaix)图。
电极电位-pH平衡图,判定一个金属腐蚀体系腐蚀过程事实上是否可能进行;判定金属表面有无可能处于钝化状态。*即在给定条件下判断发生腐蚀反应的可能性的热力学依据。
电位-pH图的绘制(a)H2=2H++2eE=-0.0591pH(b)O2+2H2O+4e=4OH-E=1.228-0.0591pH
电位-pH图的绘制(1)化学反应(反应式中无电子参加)例如:Fe2++2H2O=Fe(OH)2+2H+反应平衡常数对取定的αFe2+,平衡线是一条垂直线EPH以Fe-H2O体系为例三种不同类型的电位-pH直线*只同溶液的pH有关而同电极电位无关的化学反应
(2)无H+参与的电极反应例:Fe=Fe2++2e对取定的,平衡线是一条水平线(3)有H+参与的电极反应例:2Fe2++3H2O=Fe2O3+6H++2e对取定的,平衡线是一条斜线。PHEPHE*只同电极电位有关,而与溶液的pH无关。*既同电极电位有关,而且也与溶液的pH有关。
铁水体系的电位-pH平衡图(a)H2=2H++2eE=-0.0591pH(b)O2+2H2O+4e=4OH-E=1.228-0.0591pHFe=Fe2++2e(水平线,有e无H)E=-0.440+0.0295lgαFe2+Fe2+=Fe3++e(水平线,有e无H)E=0.771+0.0591lg(αFe3+/αFe2+)2Fe3++3H2O=Fe2O3+6H+(垂直线,无e有H)pH=-0.28-1/3lgαFe3+2Fe2++3H2O=Fe2O3+6H++2eE=0.728-0.177pH+0.0591lgαFe2+3Fe2++4H2O=Fe3O4+8H++2eE=0.980-0.236pH-0.0886lgαFe2+3Fe+4H2O=Fe3O4+8H++8eE=0.0846-0.0591pHFe3O4+H2O=3Fe2O3+2H++2eE=0.215-0.059pH3HFeO2-+4H+=Fe3O4+2H2O+2eE=-1.545+0.0296pH-0.087lgαFeO2-3Fe+H2O=HFeO2-+3H++2eE=0.396+0.0087pH+0.0296lgαHFeO2-
电位—pH平衡图的应用(1)预测腐蚀的自发进行方向(2)估计腐蚀产物的成分(3)预测减缓或防止腐蚀的控制因素
铁水体系腐蚀状态(Fe,Fe3O4,Fe2O3,25oC)A区-免蚀区B区-腐蚀区,析氢C区-腐蚀区,吸氧D区-腐蚀区,生成HFeO2-B问题:点B在腐蚀区,如何将点B移出腐蚀区?
电位—pH平衡图的局限(1)电位—pH平衡图是用热力学数据绘制的相图,只能分析体系的腐蚀倾向,不能指示腐蚀速度。(2)电位—pH平衡图仅适用于分析金属—水简单体系在室温下的腐蚀行为。(3)电位—pH平衡图只涉及纯金属,而工程上多使用合金。(4)电位—pH平衡图中的pH值是指处于平衡状态的溶液pH值,而金属表面附近溶液的pH值与主体溶液pH值是有差别的。
第十二章会计调整
第一节会计政策变更一、会计政策的含义1、会计政策:会计核算遵循的具体原则和采用的具体方法。2、重要的会计政策
二、会计政策变更条件1、法律.会计准则要求变更2、变更能提供更可靠、更相关的会计信息
三、会计变更的处理方法(一)未来适用法:从“此后”开始调整,过去的记录不更改。(二)追溯调整法:从会计事项发生时开始调整。(例1)1、计算政策变更的累计影响数累计影响数=本年期初留存收益:(按新政策计算的应有数-原政策的现有数)
2、帐务处理按“权益法下投资企业盈利”的情况处理。贷方不记“投资收益”增,而直接记“未分配利润”增。计算补交所得税不能用“投资收益”乘所得税率,而应用“投资收益”所对应的税前利润乘所得税率。
第二节会计估计变更一、会计估计及其特点1、会计估计:依据可利用的信息,对结果不确定的交易、事项作出的判断。如:对坏帐比率、固定资产预计使用年限、预计净残值、无形资产受益期就须经预先估计,方能核算。2、会计估计变更:上述判断发生改变。二、帐务处理:采用未来适用法,不溯及既往。(见例2)
第三节会计差错的更正一、会计差错:因确认、计量、记录出现错误而导致会计数据错误。二、会计差错的更正方法(一)本期发现本期错误:调整本期账户记录(用“红字更正”等方法)(二)本期发现以前年度错误。1、非重大会计差错:只在本期相同项目中调整,不改本期期初余额(即不改上年帐)——例4
2、重大会计差错—采用追溯重述法进行更正(例5)不影响损益,调整会计报表相关项目期初数。影响损益,则要调整上年利润总额、应交税金、盈余公积、未分配利润的期末余额(即本期的期初余额)。“以前年度损益调整”、损益类、账户结构类似收入类。'
您可能关注的文档
- 最新2声音的传播课件1课件PPT.ppt
- 最新2复习第五章相贯线画法课件PPT.ppt
- 最新2我爱这土地(1)课件PPT.ppt
- 最新2情感之声1课件PPT.ppt
- 最新2微生物营养与生长课件PPT.ppt
- 最新2平面连杆机构设计分析课件PPT.ppt
- 最新2数字控制器的设计数字控制器的PID设计方法1课件PPT.ppt
- 最新2机构简图绘制解析课件PPT.ppt
- 最新2电缆直埋技术课件课件PPT.ppt
- 最新2淮南子三则课件PPT.ppt
- 最新2济南的冬天(老舍)课件PPT.ppt
- 最新2磁法勘探解析课件PPT.ppt
- 最新2矿内空气动力学基础教程课件PPT.ppt
- 最新2肺和呼课件PPT.ppt
- 最新2第二章泻下剂课件PPT.ppt
- 最新2运动性疾病汇总课件PPT.ppt
- 最新3 关节学总论课件PPT.ppt
- 最新2金属在其它静载荷下的力学性能全解课件PPT.ppt