- 1.13 MB
- 2022-04-29 14:39:09 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'盐类的水解课件(hao)
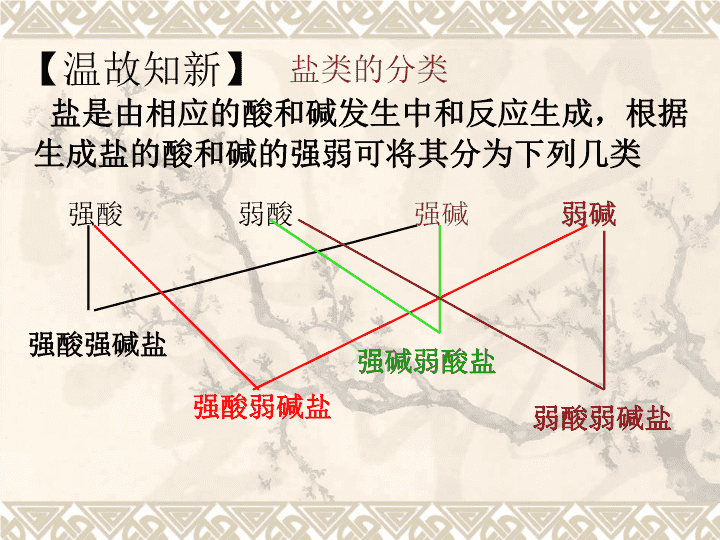
强酸弱酸强碱弱碱强酸强碱盐强酸弱碱盐强碱弱酸盐弱酸弱碱盐【温故知新】盐是由相应的酸和碱发生中和反应生成,根据生成盐的酸和碱的强弱可将其分为下列几类盐类的分类
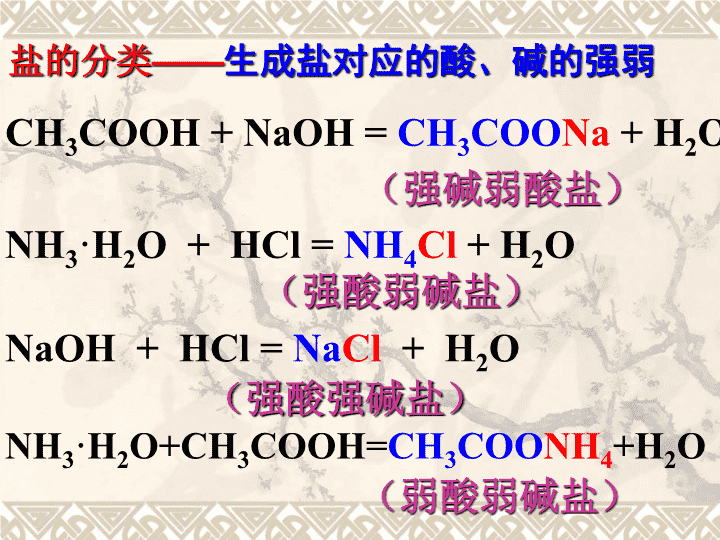
(强碱弱酸盐)(强酸弱碱盐)(强酸强碱盐)CH3COOH+NaOH=CH3COONa+H2ONH3·H2O+HCl=NH4Cl+H2ONaOH+HCl=NaCl+H2O(弱酸弱碱盐)NH3·H2O+CH3COOH=CH3COONH4+H2O盐的分类——生成盐对应的酸、碱的强弱
【课堂练习】1.下列溶液PH小于7的是()A、溴化钾B、硫酸铜C、硫化钠D、硝酸钡2.下列溶液能使酚酞指示剂显红色的是()A、碳酸钾B、硫酸氢钠C、碳酸氢钠D、氯化铁
推测CH3COONa溶液显碱性原因.推测Ⅰ:水能电离出OH-,使溶液显碱性.推测Ⅱ:醋酸钠本身具有碱性.推测Ⅲ:醋酸钠与水反应的生成物具有碱性.活动与探究二:盐溶液呈酸碱性的原因
分析CH3COONa水溶液显碱性的原因:ⅠCH3COONa水溶液中存在哪些电离?Ⅱ.CH3COONa水溶液中存在哪些粒子?它们能否结合成难电离的弱电解质物质?Ⅲ.离子相互作用时对水的电离平衡有何影响?Ⅳ.最终会引起溶液中的[H+]和[OH-]如何变化?
H2OH++OH-CH3COONa===CH3COO-+Na++CH3COOH总反应:CH3COONa+H2OCH3COOH+NaOH离子方程式:CH3COO-+H2OCH3COOH+OH-结论:CH3COONa的溶液呈碱性原因是由于盐电离产生的弱酸阴离子与水电离产生的阳离子(H+)结合生成弱电解质,导致溶液中c(OH-)>c(H+)而使溶液呈碱性。CH3COONa溶液呈酸性的原因?
请同学们试着仿照醋酸钠溶液,分析一下NH4Cl溶液呈酸性的原因?【思考时间】
以NH4Cl为例分析其溶液为什么呈酸性?NH4Cl===NH4++Cl-+NH3·H2O由于NH4+与OH-结合生成弱电解质NH3·H2O,打破水的电离平衡,使平衡右移,随之溶液中c(H+)增大,当达到新平衡时,c(H+)>c(OH-),溶液呈酸性。总反应:NH4Cl+H2ONH3·H2O+HCl离子方程式:NH4++H2ONH3·H2O+H+结论:强酸弱碱盐溶液呈酸性原因是由于盐电离产生的弱碱阳离子与水电离产生的阴离子(OH-)结合生成弱电解质,导致溶液中c(H+)>c(OH-)而使溶液呈酸性。H2OOH-+H+
弱酸阴离子或弱碱阳离子一、盐类水解的概念B:盐类的水解一般比较小溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。C:盐类的水解是吸热反应。升温促进水解。A:盐类水解是酸碱中和反应的逆反应。(2)盐类水解的特点(1)实质盐类的水解促进了水的电离,生成了弱电解质。故,盐类水解的本质是破坏了水的电离平衡,而使溶液呈现一定的酸性或碱性。
盐类水解的条件是必须有弱酸根离子或弱碱阳离子的存在,那么象NH4F、CH3COONH4这样的弱酸弱碱盐能水解吗?如果能,水解呈酸性还是碱性?活动与探究三CH3COOH的Ka为1.8×10-5HF的Ka为7.2×10-4NH3·H2O的Kb为1.8×10-5故NH4F水解呈酸性、CH3COONH4水解呈中性
NaHCO3和NaHSO3同作为弱酸酸式盐,但其水溶液酸碱性却不同,NaHCO3溶液显碱性而NaHSO3溶液显酸性,能否联系电离和水解说明原因?活动与探究四电离:NaHCO3=Na++HCO3-HCO3-H++CO32-水解:HCO3-+H2OH2CO3+OH-
(1)强酸的酸式盐只电离不水解,溶液一定显酸性,如NaHSO4=Na++H++SO42-。(2)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的大小。①若电离程度小于水解程度,溶液显碱性,如NaHS、Na2HPO4、NaHCO3等:②若电离程度大于水解程度,溶液显酸性,如NaH2PO4、NaHSO3等。酸式盐溶液酸碱性的判断
小结:盐类水解的规律有弱才水解谁弱谁水解谁强显谁性同强显中性都弱都水解
【随堂练习】盐类水解的过程中正确的说法是()A.盐的电离平衡破坏B.水的电离平衡发生移动C.溶液的pH减小D.没有发生中和反应B
H2OH++OH-CH3COONa===CH3COO-+Na+总反应:CH3COONa+H2OCH3COOH+NaOH离子方程式:CH3COO-+H2OCH3COOH+OH-NH4Cl===NH4++Cl-H2OOH-+H+总反应:NH4Cl+H2ONH3·H2O+HCl离子方程式:NH4++H2ONH3·H2O+H+水解方程式
盐类水解是可逆反应,反应方程式中要写“”符号NH4++H2ONH3·H2O+H+HCO3-+H2OH2CO3+OH-二.盐类水解方程式的书写一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成分解产物的形式。(除彻底双水解外)
多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。多元弱酸的盐分步水解,以第一步为主,水解方程式一般只写第一步。HCO3-+H2OH2CO3+OH-CO32-+H2OHCO3-+OH-Al3++3H2OAl(OH)3+3H+
D习题:下列水解离子方程式正确的是()A、Fe3++3H2OFe(OH)3↓+3H+B、Br-+H2OHBr+OH-C、CO32-+H2OH2CO3+2OH-D、NH4++H2ONH3.H2O+H+
下列方程式中是正确的盐类水解的离子方程式的是:A、HS-+H2OH3O++S2-B、NH4++H2ONH3·H2O+H+C、CO32-+H2OH2CO3+2OH-D、Fe3++3H2OFe(OH)3↓+3H+B注意区分水解和电离:水解是弱碱离子夺取了水的H+或OH-,电离是水夺取了溶质的阳离子
完成下列水解过程的离子方程式NaCNNaClONa2SO3FeCl3
双水解:(1)一般的双水解:阴阳离子都水解,互相促进,但程度不是很大,仍能在溶液中大量共存的,如NH4HCO3、(NH4)2CO3等。(2)剧烈双水解:阴阳离子都水解,互相促进,水解进行完全,不能在溶液中大量共存的:①Al3+与HS-、S2-、SiO32-、C6H5O-、AlO2-、CO32-、HCO3-②Fe3+与SiO32-、C6H5O-、AlO2-、CO32-、HCO3-③NH4+与SiO32-、AlO2-了解内容、不做深究
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑Al3++3AlO2-+6H2O=4Al(OH)3↓Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO双水解的离子方程式的书写双水解离子方程式书写注意:1、用“=”2、产物要标“↓”或“↑”了解内容、不做深究
四、影响盐类水解的因素1、内因:组成盐的离子对应的酸或碱越弱,水解程度越大越弱越水解例:物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是()A.HX、HZ、HYB.HZ、HY、HXC.HX、HY、HZD.HY、HZ、HX
填表:CH3COONa溶液,改变下列条件,填写变化情况:CH3COO-+H2OCH3COOH+OH-改变条件平衡移动c(CH3COO-)c(OH-)水解程度加入CH3COONa通入HCl升温加水加NaOH加CH3COOH加NH4Cl向右增大增大减小向右减小减小增大向右减小增大增大向右减小减小增大向左向左增大增大增大减小减小减小向右减小减小增大
2、外因浓度越大,水解程度越小温度越高,水解程度越大越稀越水解越热越水解
练习、比较下列溶液的pH大小1、0.1mol/LNH4Cl溶液____0.01mol/LNH4Cl溶液2、0.1mol/LNa2CO3溶液____0.1mol/LNaHCO3溶液3、25℃1mol/LFeCl3溶液____80℃1mol/LFeCl3溶液4、0.1mol/LNH4Cl溶液____0.1mol/LNa2CO3溶液<>><
盐类水解的规律难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越弱越水解,都弱都水解;谁强显谁性,都强显中性,弱弱具体定;越弱越水解,越热越水解,越稀越水解。
1、判断盐溶液的酸碱性及其强弱五、盐类水解的应用溶液pH由小到大的顺序:强酸>弱酸>电离程度大于水解程度的酸式盐>强酸弱碱盐>强酸强碱盐>强碱弱酸盐>弱碱>强碱例如:0.1mol/l下列溶液PH值由大到小的顺序是_________________①H2SO4②NH3.H2O③NaOH④NH4Cl⑤NaCl⑥CH3COONa⑦HCl⑧CH3COOH⑨Ba(OH)2⑨>③>②>⑥>⑤>④>⑧>⑦>①
1.(09年重庆10)物质的量浓度相同的下列溶液,pH由大到小排列正确的是A.Ba(OH)2、Na2SO3、NH3·H2O、KClB.Na2SiO3、Na2SO3、KNO3、NH4ClC.NH3·H2O、H3PO4、Na2SO4、H2SO4D.NaHCO3、C6H5COOH、C2H5OH、HClB高考真题
2、比较盐溶液中离子种类和浓度大小练习1:将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子种类最多的是()A.KClB.Na3PO4C.Na2CO3D.MgSO4五、盐的水解的应用B分析:NaF溶液中含有那些离子,浓度大小顺序怎样?Na2CO3溶液呢?
常用规律:电荷守恒、物料守恒、质子守恒电荷守恒:阳离子所带正电荷总数=阴离子所带负电荷总数离子浓度大小比较请分别写出CH3COONa溶液、Na2CO3溶液中电荷守恒的表达式
物料守恒(原子守恒):即某种原子在变化过程(水解、电离)中数目不变。例:在Na2CO3溶液中,Na数目是C数目的2倍,而在变化过程中,碳原子以CO32-、HCO3-、H2CO3的形式存在,所以由N(Na)=2N(C)得C(Na+)=2[C(CO32-)+C(HCO3-)+C(H2CO3)]试着写出Na2S溶液中物料守恒表达式
质子守恒:溶液中分子或离子得到质子和失去质子的物质的量或浓度相等(以NaHCO3溶液为例)Na+HCO3-H2OH2CO3H3O+CO32-OH-得到H+失去H+质子守恒可由物料守恒式和电荷守恒式推导得出,请写出NaHCO3溶液的物料守恒和电荷守恒表达式,然后推出质子守恒表达式
产后血晕广州中医药大学妇科教研室许丽绵
目的与要求掌握:产后血晕定义、中西医应急处理和辨证论治。熟悉:产后血晕的病因病机。认识产后血晕危及生命。
定义产妇分娩后突然头晕眼花,不能起坐,或心胸满闷,恶心呕吐,痰涌气急,心烦不安,甚则神昏口噤,不省人事,称为“产后血晕”。本病为产后危重急症之一,属于“三冲”。西医学的产后出血、羊水栓塞可参本证。
历史沿革《诸病源候论》列“产后血运闷候”,指出“运闷之状心烦气欲厥是也”,“亦有去血过多,亦有下血极少,皆令运。若产去血过多,血虚气极,如此而运闷者,但烦闷而已;若下血极少,而气逆者,则血随气上,掩于心,亦令运闷,则烦闷而心满急。二者为异。亦当候其产妇血下多少,则知其产后应运与不运也。然烦闷不止,则死人”。
历史沿革《经效产宝·产后血晕闷绝方论》“产后血晕者,其状心烦,气欲厥是也。···若下血多晕者,但烦而已。下血少而气逆者,则血随气上捺,心下满急······若不急疗,即危其命也”。并提出多条急救方。
历史沿革《妇人大全良方》“眼见黑花,头晕目眩,不能起坐,其致昏闷不省人事”,“下血多晕郁者······补血清心药治之,下血少而晕者·····破血行血药治之。《景岳全书·妇人规》“但察其面白、眼闭、口开、手冷。六脉细微之甚,是即气脱证也”;“如果形气脉气俱有余,胸腹胀痛上冲,此血逆证也”。虚者以人参急煎浓汤,实者宜失笑散治之。
历史沿革《傅青主女科·产后血晕不语》“急用银针刺其眉心,得血岀则语矣,然后以人参一两煎汤灌之,无不生者”。
病因病机:虚者阴血暴亡,心神失守
实者瘀血攻心,扰乱心神素体气血虚弱产时失血过多(虚:血虚气脱)产后百脉空虚感受风寒(实:瘀阻气闭)营阴下夺气随血脱心神失守血为寒凝瘀滞不行血瘀气逆上扰神明血晕
产后出血的原因:子宫收缩乏力:最常见胎盘因素:胎盘滞留、胎盘粘连、胎盘植入、胎盘胎膜残留产道损伤:会阴、阴道、宫颈凝血障碍:妊娠合并凝血功能障碍性疾病(妊娠禁忌)、妊娠或分娩期并发凝血功能障碍。
诊断病史:严重贫血史、血小板减少症、凝血功能障碍或产时软产道的裂伤、产后宫缩乏力,胎盘剥离不全、剥离后滞留、胎盘嵌顿、植入或胎膜残留等。临床表现:见定义。常常见有阴道大出血。检查:产科检查:辅助检查:凝血功能检查,如血小板、凝血酶原时间、纤维蛋白原等。DIC的相关检查。EKG。鉴别:产后郁冒、产后痉病、产后子痫。
紧急处理治疗原则:急则治其标,缓则治其本针对出血原因迅速止血,补充血容量,抗休克,预防并发症和预防感染。1立即将产妇仰卧位,头低脚高2针灸:强刺激眉心、人中、涌泉等3中药:固脱救厥。常用丽参针、参麦针、参附针4西医疗法:针对病因进行治疗吸氧、补液输血、抗休克、预防治疗并发症。
辨证论治辨虚实,分脱证、闭证。虚者为脱,实者为闭。治则:救脱开闭治法:虚者益气固脱,实者行血逐瘀。
1、血虚气脱主症:产时或产后失血过多,突然晕眩,面色苍白,心悸愦闷,甚则昏不知人,眼闭口开,手撒肢冷,冷汗淋漓。舌淡无苔,脉微欲绝或浮大而虚。治法:益气固脱方药:参附汤《校注妇人良方》或扶阳救脱汤参附汤:人参附子
2、瘀阻气闭主症:产后恶露不下或量少,小腹阵痛拒按,突然头晕烟花,不能起坐,甚则心下急满,气粗喘促,神昏口噤,不省人事,两手握拳,牙关紧闭,面色青紫,唇舌紫黯,脉涩。治法:行血逐瘀方药:夺命散加当归、川芎《校注妇人良方》或黑神散加琥珀。夺命散:没药血竭
针对病因治疗子宫收缩乏力:按摩子宫、宫缩素、手术(宫腔填塞术、盆腔血管栓塞术、子宫切除术)胎盘因素:产道损伤:凝血障碍:
预防与调摄1.注意做好孕期保健;2.提高助产技术;3.注意子宫收缩及阴道出血情况4.一旦发生产后出血量多,须迅速查明病因,及时治疗。不管是脱证或闭证,均为危证。尽早、及时、有效的抢救治疗或能挽救生命。'
您可能关注的文档
- 最新皮肤科门诊常用药[最新]课件PPT.ppt
- 最新皮肤结构与功能课件PPT.ppt
- 最新皱纹纸《玫瑰花》手工课件课件PPT.ppt
- 最新盆腔包块的诊断与处理05课件PPT.ppt
- 最新盐化学肥料总复习课件PPT.ppt
- 最新益赛普治疗幼年特发性关节炎专家共识课件PPT.ppt
- 最新盈利能力分析课件PPT.ppt
- 最新盐类水解反应的利用(一)课件PPT.ppt
- 最新盐类的水解课件(公开课)课件PPT.ppt
- 最新盘溪伊尹(自用)课件PPT.ppt
- 最新盖洛普Q12数据分析课件PPT.ppt
- 最新目前国内养殖的白玉蜗牛课件PPT.ppt
- 最新目力保健专题常识讲座2[精品]课件PPT.ppt
- 最新目标八:防范与减少患者压疮事件发生。课件PPT.ppt
- 最新直流CT工作原理课件PPT.ppt
- 最新直线与椭圆的位置关系课件PPT.ppt
- 最新直线与方程复习课课件PPT.ppt
- 最新直线与方程复习课件PPT课件.ppt